|
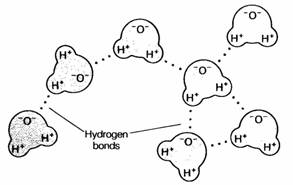
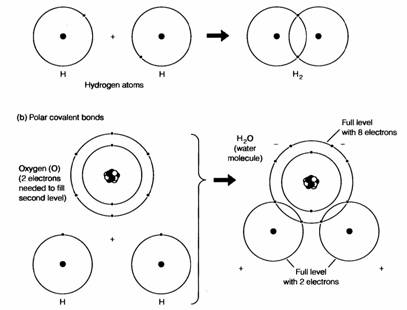
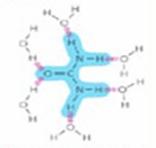
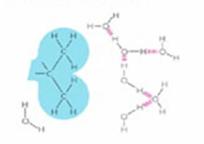
Vodíková (hydrogenová) vazba a její vlastnosti Co způsobuje, že voda má tak specifické chemické vlastnosti a je tak nezbytná pro život? Je to právě vodíková vazba (neboli hydrogenová vazba, vazba vodíkových můstků) mezi jednotlivými molekulami vody a dalšími látkami, která umožňuje existenci života. Obr. Vodíková vazba Atom vodíku může být sdílený dvěma různými atomy, v tomto případě 2 atomy kyslíku ze 2 molekul vody; tento druh vazby je slabý a snadno se štěpí, ale hraje významnou roli při interakcích molekul v živých organismech; molekuly vody na obrázku jsou znázorněny způsobem, který zohledňuje trojrozměrný tvar oblastí, ve kterých se vyskytují obíhající elektrony Zdroj: Postlethwait et al., 1991 Vzpomeňte si, že voda je polární molekula s pozitivním a negativním koncem. Když pozitivně nabitý konec jedné molekuly přitahuje negativně nabitý konec molekuly druhé, tvoří se vodíkové vazby. Proto jsou v tekuté vodě jednotlivé molekuly propojeny v rozsáhlé shluky. Tyto vazby vysvětlují několik důležitých vlastností vody, které se týkají teploty. Obr. Kovalentní vazba a) když se atomy vodíku přiblíží k sobě, překryjí se jejich elektronové orbity a vytvoří se kovalentní vazba; protože je rozdělení náboje v této molekule symetrické, říkáme ji nepolární kovalentní vazba a molekula je elektricky neutrální b) v molekule vody jádro atomu kyslíku s 6 protony přitahuje 2 elektrony atomů vodíku silněji než jejich vlastní jádra; díky tomu sdílené elektrony stráví při oběhu více času na straně kyslíku a ten pak získává slabý záporný náboj, vodíky vykazují slabý náboj kladný; tento typ vazby se nazývá polární kovalentní vazba protože určité oblasti (póly) molekuly mají slabý pozitivní či negativní náboj Zdroj: Postlethwait et al., 1991 Voda je v rozsahu většiny teplot na naší zeměkouli v tekutém skupenství, protože odolává zahřívání – její teplota stoupá pomalu; voda má vysoký bod varu (1000 C) a nízký bod tuhnutí (00 C).
Tab. Srovnání vlastností hydridů kyslíku (vody) a prvků blízkých v periodické soustavě Zdroj: Hutchinson, 1957
To je způsobeno tím, že tepelná energie dodaná
vodě při ohřívání musí nejprve přetrhat vodíkové vazby mezi jejími
molekulami dříve než může zvýšit rychlost pohybu jednotlivých molekul vody a
tak zvýšit její teplotu.
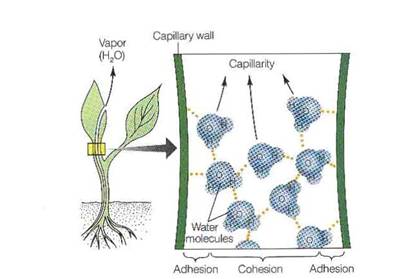
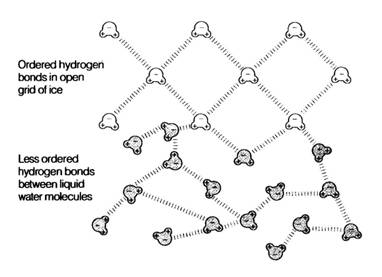
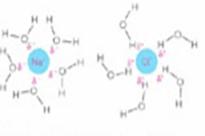
Obr. Kapilarita: Vodní molekuly přilnou ke stěnám kapilár nad sebou a k ostatním molekulám vody pod sebou. Zdroj: Postlethwait et al., 1991 Vodíková vazba přispívá k tvorbě poměrně rigidní a otevřené molekulární struktury ledu, jejímž důsledkem má led menší hustotu než voda a plave na jejím povrchu. V zimě tak izoluje spodní vrstvy vodních toků a nádrží, které zůstávají tekuté a umožňují přežití vodních organismů. Obr. Krystalická struktura ledu: vodíkové vazby uspořádané v otevřené mřížce ledu a málo uspořádané v kapalině. Zdroj: Postlethwait et al., 199 Vodíková vazba rovněž pomáhá vysvětlovat její nejdůležitější chemickou vlastnost – schopnost rozpouštět jiné látky a působit tak jako solvent. S některými rozpuštěnými látkami vytváří voda vodíkové vazby – to je případ cukru, rozpouštěného v šálku čaje. U jiných rozpuštěných látek – např. solí - je úloha vody ještě podstatnější. Ionty, tvořící soli, ve vodě disociují a každá z nich je obklopena orientovaným shlukem vodních molekul. Látky, které se ve vodě snadno rozpouštějí, se nazývají hydrofilní. Obr. Hydrofilní molekuly: ionty jako sodík nebo chlór jsou rozpustné, protože molekuly vody jsou přitahovány jejich pozitivním nebo negativním nábojem; polární molekuly, jako např. močovina, se rozpouštějí, protože jejich molekuly tvoří s okolními molekulami vody vodíkovou vazbu Zdroj: htpp://www.essentiacellbiology.com Na druhou stranu, látky jako olej, vosk nebo plastické hmoty se snadno nerozpouštějí a nazýváme je hydrofobními. Snaha vody vypudit ze svého středu molekuly hydrofobní látky je tak značná, že ji označujeme jako hydrofobní sílu. Navenek se projevuje tak, jako by se hydrofobní látky aktivně k sobě přitahovaly. Ve skutečnosti však jde o projev vypuzovací tendence vody. Obr. Hydrofobní molekuly: molekuly, které obsahují převážnou část nepolárních vazeb (jako např. uhlovodíky s mnoha C-H vazbami) se obvykle ve vodě nerozpouštějí, protože nepřitahují vodní molekuly, které by je obklopily a převedly do roztoku |