|
Lotický systém - chemismus Mezi součásti říční vody patří rozptýlené anorganické látky, nejdůležitější rozpuštěné ionty, rozpuštěné živiny, rozptýlené a rozpuštěné organické látky, plyny a stopové prvky. Z rozpuštěných plynů nás nejvíce zajímá rozpuštěný kyslík a oxid uhličitý. Vzájemná výměna obou těchto plynů s atmosférou udržuje jejich koncentraci blízko ekvilibria (rovnováhy), určeného teplotou a parciálním atmosférickým tlakem, a to zejména u toků, které jsou malé a turbulentní. Fotosyntetická aktivita ve velmi produktivních podmínkách, obvykle probíhající u vláknitých řas a makrofyt, dokáže zvýšit hladiny kyslíku nad úroveň saturace (150 % a více) a má za následek, že jeho koncentrace je značně odlišná ve dne a v noci. K vysokému nasycení vody kyslíkem rovněž dochází v peřejnatých úsecích, ve vodopádech a na jezech.
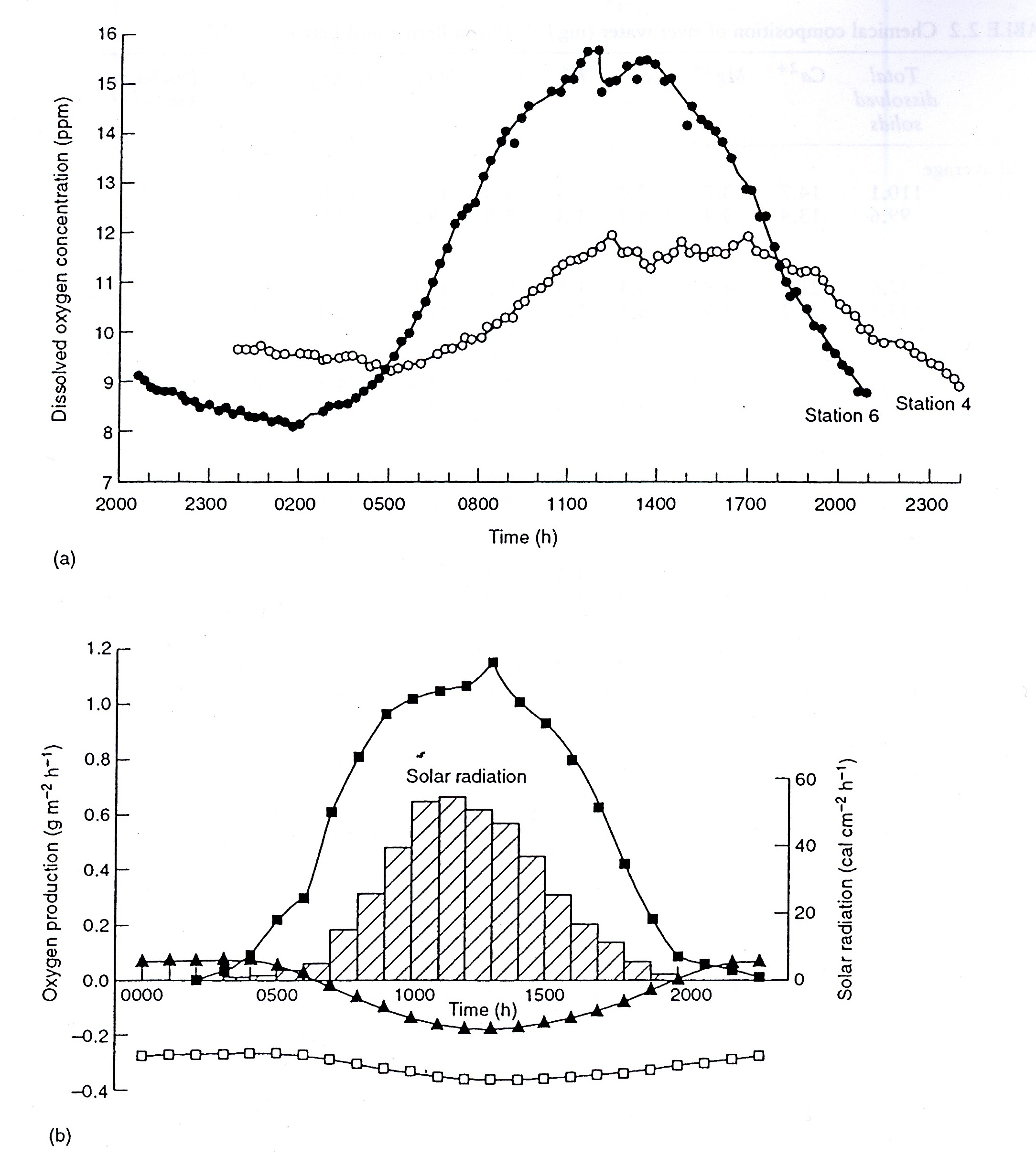
Obr. (a) 24h měření koncentrací kyslíku na
dvou místech toku: ○ na horním toku ● na dolním toku Zdroj: Allan, 1995 Respirace má efekt opačný, snižuje koncentrace kyslíku a zvyšuje CO2. Také velké množství organického odpadu může snížit koncentraci kyslíku pod úroveň, umožňující přežití organismů, a zvýšit koncentraci CO2 na několikanásobek jeho parciálního tlaku v atmosféře. U znečištěných vod se koncentrace kyslíku v letním období většinou pohybuje v rozmezí mezi 8-12 mg.l-1, v zimním období pak mezi 6-8 mg.l-1. V tocích se mezi přírůstkem a úbytkem koncentrace kyslíku po určité době vytváří rovnováha, nazývaná kyslíková. Rovnovážný stav kyslíkové bilance v toku můžeme vyjádřit Streeter-Phelpsovou rovnicí: Lt . K1 = Dt . (K2-K1) Lt …. zatížení toku organickými látkami v čase t K1…….deoxygenační konstanta Dt …. deficit kyslíku za dobu t K2 …. reareační konstanta (koeficient rychlosti rekreace) Obě konstanty mají pro různé typy toků různou hodnotu a jsou ovlivňovány teplotou. K2 při teplotě 20 oC má pro bystřinný tok rozsah 0.05-0.8, pro pomalé větší toky 0.15-0.20. K1 pro samočištění v nezatěžovaných tocích může být 0.1-0.3 Kyslíková bilance je zdrojem informací pro zhodnocení látkového zatížení toku a jeho samočisticí schopnosti. Modelování a predikce samočisticího procesu v podélném profilu toku pak vychází z křivky kyslíkového průhybu.
Obr. Křivka kyslíkového průhybu: cr …. rovnovážná koncentrace , Ck…. kritická koncentrace, K… kritický bod, tk…. kritický čas. Přítokem látek, schopných biochemického rozkladu v čase, dochází ke snížení koncentrace kyslíku. V kritickém bodě se procesy rekreace a spotřeby kyslíku vyrovnají. Za kritickým bodem již převládá rekreace. Zdroj: Lellák, Kubíček, 1991 Teplota vody v tocích vykazuje denní a sezónní oscilace. Kolísání teploty je závislé na výkyvech teploty vzduchu (osvětlené mělké toky), na přítoku podzemní vody, na zastínění toku a také na antropických vlivech. Obecně platí, že nejpravděpodobnější průměrnou denní teplotu našich toků můžeme určit podle jejich teploty mezi 10 a 12 hodinou. Maximální denní teplota připadá v celoročním průměru na dobu od 14 do 17 hodin (v zimě dříve, v létě pak později). Roční průběh teploty v tocích se poněkud zpožďuje za vývojem teploty vzduchu. V našich tocích je dlouhodobý roční průměr teploty od 5.4 oC až 11.9o C, nejčastěji kolem 9 oC. Denní teploty se v průběhu roku pohybují od 0-34 oC. Denní teplotní změny změny tvoří u malých toků 3-6 oC, u větších řek kolem 1 oC. Díky převážně turbulentnímu charakteru proudění je ve většině toků stálá vertikální homotermie. Naopak pro příčný profil toku je zřetelná amfitermie (v létě se břehové části prohřívají a v zimě zamrzají rychleji než voda v proudnici). Na složení říční vody má vliv mnoho faktorů, a v důsledku této skutečnosti má říční voda velmi různorodé chemické složení. Koncentrace hlavních rozpuštěných iontů (Ca2+, Na+, Mg2+, K+, HCO3-, SO42-, Cl-) dosahuje v součtu celosvětového průměru zhruba 100mg/l. Nicméně říční voda je velmi různorodá a tato koncentrace může být v rozsahu od několika mg/l tam, kde se říční voda sbírá v povodí, tvořeném velmi tvrdými horninami, až po několik tisíc mg/l v oblastech aridních. Tab. Chemické složení říční vody (mg/l). Zdroj: Allan, 1995 Odlišnost jednoho místa od druhého je dána především typem hornin, které podléhají zvětrávání, množstvím srážek a také složením dešťové vody, která je zase výsledkem vzdálenosti místa srážek od moře. Celková koncentrace rozpuštěných solí je zhruba dvojnásobná v řekách, odvádějících vodu ze sedimentovaných hornin, oproti řekám z oblastí vyvřelých a metamorfovaných, což je způsobeno různou schopností těchto hornin odolávat erozi. Oblasti s vysokými srážkami a rychlým odtokem povrchové vody z krajiny mají obvykle nižší koncentraci solí ve vodě než aridní oblasti, kde dochází k vyššímu výparu a tudíž menšímu naředění. Vstup chemických látek ze srážek nemá obvykle pro říční vody takový význam, s výjimkou oblastí s vysokými srážkami a rychlým odtokem povrchové vody. Lidskou činností vstupuje do říční vody znečištění například v podobě dešťové vody, jako suché depozity (přínos větrem), odnosem hnojiv nebo posypových solí při prudkých lijácích případně jako přímé vypouštění odpadních látek. Chemismus vody v řece se mění v čase pod vlivem různých sezónních změn režimu průtoku, množství srážek a biologické aktivity organismů. Podzemní vody jsou ve srovnání s vodou povrchovou obvykle více koncentrované a méně variabilní, protože jsou v kontaktu s horninami po delší čas. V povodích v nenarušených oblastech jsou koncentrace některých iontů velmi imunní vůči změnách průtoku až v rozsahu několika řádů. Nicméně protože dešťové srážky zvyšují podíl povrchové vody na toku, koncentrace iontů bývají často naředěny zvýšením objemu toku. Voda v přírodě obsahuje roztok oxidu uhličitého, kyseliny uhličité a uhličitanových a hydrogenuhličitanových iontů v takové rovnováze, která slouží jako hlavní určující faktor její acidobazické rovnováhy. Sladká voda může mít široký rozsah kyselosti či zásaditosti, a to až do extrémních hodnot (výrazně pod 5 nebo nad 9), které jsou pro většinu organismů škodlivé. Hydrogenuhličitanový pufrační systém, sestávající z rovnovážného stavu CO2 – HCO3- - CO32- poskytuje kapacitu tlumení výkyvů pH, která je nezbytná pro zdravý život sladkovodních organismů. Přestože je sladká voda velmi různorodá co do jejího chemického složení, a pro řeky to platí ještě více než pro jezera, biologický význam těchto rozdílů je viditelný pouze v extrémních případech anebo tam, kde hraje další podstatnou roli znečištění lidskou činností. Ve vodě s velmi nízkou koncentrací iontů nacházíme jen omezený počet druhů živočichů, zejména korýšů a měkkýšů. Obecně počet druhů roste s rostoucí tvrdostí vody; mnohé druhy pak jednoznačně preferují buď měkkou nebo tvrdou vodu. Antropogenní vypouštění silných anorganických kyselin do vody startuje množství změn v jejím chemismu, a při poklesu pH hlouběji pod 5 jsou následky pro život ve vodě velmi vážné. |