|
Acidifikace vodních ekosystémů Během posledních několika desetiletí byla široce rozšířená acidifikace akvatických ekosystémů popsána z čási Skandinávie, Kanady a USA a stala se závažným problémem. Tento fenomén je připisován depozicím aerosolů H2SO4 a HNO3. Kromě snížení pH vody jezer a toků mohou kyselé srážky uvolnit toxické těžké kovy, jako např. hliník. Kombinace zvýšeného množství H+ iontů a těžkých kovů může eliminovat většinu typů vodního života. Angličan Robert Angus Smith byl pravděpodobně první, kdo použil v roce 1850 ve své studii kyselých srážek v Manchesteru pojmu "kyselý déšť". Od roku 1940 je známo, že polutanty včetně atmosférických kyselin mohou být transportovány větrem na velké vzdálenosti. Systém dálkového transportu byl studován především skandinávskými vědci, kteří zjistili, že srážky nad Skandinávií jsou mnohem kyselejší, a že většina kyselých škodlivin pochází z emisí průmyslových oblastí střední a západní Evropy a Anglie. Usoudili, že se jedná o mezinárodní problém, který je nezbytné řešit pouze mezinárodní spoluprací. Proto od roku 1972 probíhá evropský výzkumný projekt sledování dálkového transportu, tzv. LRTAP („Long-Range Transport Atmospheric Programme“), který přinesl zajímavá zjištění. Ve zprávě tohoto programu z roku 1977 se např. uvádí, že pouze 20-30 % celkové depozice síry ve Švédsku v roce 1974 (cca 500.000 t/rok) má původ ve Švédsku. V roce 1979 byla přijata "mezinárodní vzdušná konvence" (The Protocol to the 1979 Convention on Long Range Transboundary Air Pollution on Further Reduction of Sulphur Emissions), kterou ratifikovalo 33 států. Výzkumný program si vytýčil studium následujících problémů:
Zdroje acidity Příčinou vzniku kyselé atmosférické depozice, označované populárně jako kyselý déšť, jsou emise oxidu siřičitého (SO2), který vzniká zejména spalováním hnědého uhlí a emise oxidů dusíku (NOx) způsobené hlavně vysokoteplotním spalováním v automobilových motorech. SO2 a NOx v atmosféře a na povrchu vegetace dále oxidují za vzniku kyseliny sírové (H2SO4) a kyseliny dusičné (HNO3-) , které snižují pH srážkové vody. Tato kyselá voda (tj. kyselý déšť, sníh nebo mlha) se dostává na zemský povrch a startuje řetěz reakcí vedoucí k okyselení půd a povrchových vod – tzv. environmentální acidifikace, jehož důsledkem jsou uhynulé horské lesy, kyselé povrchové vody bez ryb, podzemní vody s vysokým obsahem toxických kovů uvolněných z půd a hornin. V České republice hraje nejdůležitější roli v okyselování půd kyselina sírová. Z atmosféry se na zemský povrch dostává dvěma mechanizmy. Prvním je vlastní kyselý déšť, správněji „mokrá depozice“ (wet deposition), druhým je „suchá depozice“ (dry deposition) síry. Ta se uplatňuje v oblastech s vysokými koncentracemi SO2 v ovzduší. „Vysokými“ koncentracemi se v tomto kontextu rozumí průměrné roční koncentrace vyšší než 3-5 mg/m3 (Hruška et al. 1996). Mechanismus suché depozice je zhruba následující: SO2 a síranový aerosol z atmosféry se zachycují na povrchu vegetace, kde SO2 oxiduje na H2SO4, která je při nejbližším dešti spláchnuta do půdy. Nejvíce síry zachycuje smrkové jehličí, listnaté opadavé dřeviny ji zachytí výrazně méně. Suchá depozice síry tvoří na území ČR zhruba dvě třetiny celkové depozice a je rozhodujícím faktorem okyselování zalesněných oblastí (Hruška et al. 1996). Hošek a Kaufman (1995) uvádí SO2 jako hlavní zdroj acidity v Krkonoších a zjistili rovněž zvyšující se koncentrace síranů směrem od západu na východ. V západní oblasti naměřili množství síranů: 148 kg/ha/rok a v oblasti Bílého Labe až 148 kg/ha/rok.
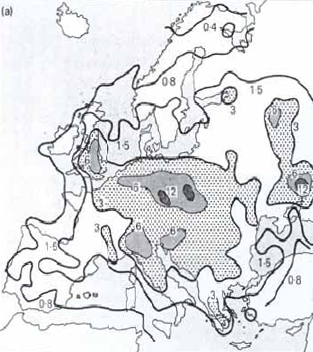
Konverze oxidů na kyselinu sírovou či dusičnou je velmi rychlá, přibližně 100 % za 1 hodinu v létě a 20 % / 1 hodinu v zimě. V „suché atmosféře“ se na vzniku obou kyselin podílí komplex fotochemických reakcí, zahrnujících vysoce reaktivní složky, jako např. ozón. Konverze oxidů na kyseliny je ve srovnání s „vlhkou atmosférou“ mnohem pomalejší, přibližně 16 % /den v létě a 3 % /den v zimě (Mason 1991). Kyseliny z těchto reakcí dopadají na zemský povrch ve formě plynné nebo částeček. Produkce kyselin z plynných prekurzorů je limitována dostupností oxidizujících složek, uhlovodíků a slunečního UV záření. Existují důkazy, že atmosféra severní polokoule je v současnosti reaktivnější než tomu bylo před několika desítkami let, což přispívá k akceleraci procesů acidifikace (Mason 1991). Normální, neznečištěné srážky mají pH obvykle kolem 5.6 v důsledku přítomnosti kyseliny uhličité, vzniklé reakcí vody a CO2 ve vzduchu. Přírodní procesy, jako např. sopečné emise nebo biologický rozklad mohou sice snížit pH srážek pod 5.6, ale alkalický prach jej naopak zvyšuje nad pH 7. V průmyslových oblastech jsou však antropogenní okyselení ovzduší obvykle daleko větší ve srovnání s přírodními zdroji. Na velkém území mají srážky hodnotu pH 4.0 - 4.54, lokálně toto pH klesá na 3.0 viz. obr. Pokles pH srážek je možné proto využít jako indikátor okyselování (Obr.). V globálním měřítku jsou antropogenní emise síry řádově srovnatelné s emisemi z přírodních zdrojů, ale regionálně v severní Evropě a na východě Severní Ameriky přes 90 % atmosférické depozice síry je antropogenního původu (Schindler 1988). Kyselina sírová se podílí zhruba 70 % na průměrné celkové roční kyselosti srážek v severozápadní Evropě a cca 60 % na východě USA, zbytek připadá na kyselinu dusičnou. Ačkoliv většina kyselého znečištění dopadá na zemský povrch v oblasti produkce, určitá část může být transportována větrem tisíce kilometrů, než je v podobě srážek vymyta z atmosféry. Odhaduje se, že zhruba 17 % kyselých depozic v Norsku pochází z Anglie a 20 % depozic spadlých ve Švédsku z východní Evropy, viz obr.
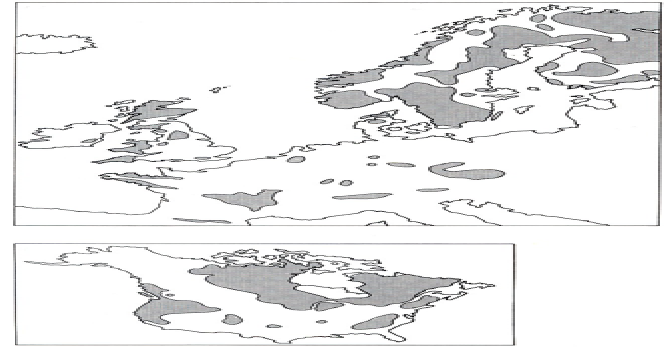
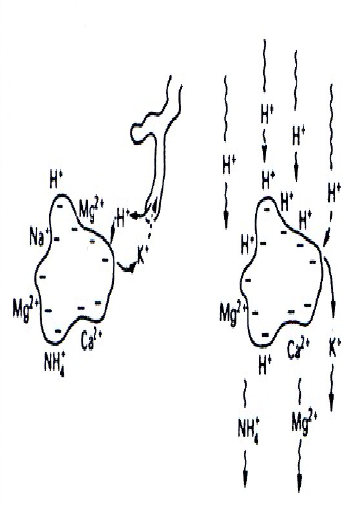
Vedle množství depozice rozhodují o stupni okyselení vodního prostředí stavba okolních hornin a vlastnosti půd, zejména množství bazických kationtů (Ca2+, Mg2+, Na+, K+), jejichž zdrojem je zvětrávání podložních hornin. Čím více je v půdách bazických kationtů, tím jsou odolnější, protože mohou déle neutralizovat kyselý přísun z atmosféry.Oblasti s bazickými (vápence, magnezit) horninami jsou méně senzitivní a náchylné k acidifikaci. Naopak rychlé příznaky acidifikace se projeví brzy v oblastech s podložím tvořeným žulami a rulami. Rozsah území, která jsou senzitivní k okyselení, je dnes mnohem větší, než se předpokládalo před 20 lety a zahrnuje oblasti USA a Kanady, většinu Evropy a rozsáhlé části Asie, Afriky a Jižní Ameriky, tvořené prekambrickými a kambrickými horninami (Schindler 1988). Povodí senzitivní ke kyselosti mají všeobecně malou zásobu dostupných a výměny schopných bazických kationtů (Ca2+, Mg2+, Na+ , K+). Tato povodí mají rovněž limitovanou kapacitu k zachycování silných kyselých aniontů (SO42-, NO3-), proto vysoký přísun silných kyselin bez dostatečného vyplavení bazických kationtů vyústil v nekompletní neutralizaci a následný transport kyselých kationtů (H+, kovů jako Aln+) a stopových kovů (Mn2+, Zn2+) z půd do povrchových vod. Obr. Oblasti Evropy a Ameriky senzitivní k acidifikaci Nejméně odolné jsou horské půdy, které mají malou mocnost a přirozeně nízké množství bazických kationtů. V horách se devastující vliv kyselých dešťů projevuje nejdříve, protože jsou v nich vysoké srážky, časté mlhy, vysoká rychlost větru a převaha smrkových monokultur. To celkovou depozici síry výrazně zvyšuje. Vliv zalesnění na acidifikaciV souvislosti s acidifikací vodních ekosystémů byly prováděny rozsáhlé výzkumy zaměřené na zjištění vlivu lesních porostů a zalesňování na acidifikaci vodních ekosystémů. Tyto studie prokázaly, okyselování toků v důsledku přítomnosti jehličnatých lesů, zvláště na kyselém podloží (Raulund-Rasnussen a Boggaard, 1991, Nielsen et al.,1993 in Friberg et al., 1998). Bylo zjištěno, že pod zápojem jehličnanů se zvyšují koncentrace iontů sulfátů, vodíku, chloridů, hořčíku, draslíku a vápníku a klesá hodnota pH. V Krkonoších bylo naměřeno v letech 1985-1987 až 8 mg/l síranů ve srážkách na volném prostranství a až 55 mg/l ve srážkách v lese (Vávra, 1988). Půda v podloží a půdní voda jsou okyselovány, což vede k mobilizaci železa a mnohem významněji hliníku. Tyto ionty společně s vodíkem a dalšími okyselujícími látkami, jako jsou dusičnany a sírany, jsou pak transportovány v půdních roztocích do akvatického prostředí (Tierney et al. 1998). V jehličnatých lesích dochází k pomalejší dekompozici opadu, ionty H+ jsou vyloučeny do půdní vody výměnou za kationty v době růstu (Bergen et al.,1987 in Friberg et al., 1998) a jehličnany mají také větší schopnost pohlcovat kyselé srážky z atmosféry (Harriman and Morrison,1982 in Friberg 1998). Jehličnany mají povrchový kořenový systém a využívají pouze svrchní vrstvu půdy a ta se stává více kyselou než pod listnatými dřevinami, kterým kořeny prorůstají hlouběji (Bergen et al.,1987 in Friberg et al., 1998). Výměna kationtů mezi půdou a stromem zrychluje u rychle rostoucích dřevin, jako je např. smrk (Picea spp.), a přispívá tak ještě více k acidifikaci (Nilsson,1993 in Friberg et al., 19984). Obr. Kationtová výměna na půdních částicích V našich podmínkách Vávra (1988) uvádí při srovnání pH lučních a lesních toků v Krkonoších, že při průtoku vody lesem došlo ke snížení pH o 1,4. Naopak smíšený porost má obecně menší vliv na okyselování půdy a tím i povrchové vody (Liljelund et al,1986 in Friberg et al., 1998). Vztah mezi lesním porostem a chemismem toků je znázorněn v obr. Nilssen (1980) prokázal, že kácení lesních porostů je příčinou zvyšování acidity toků.
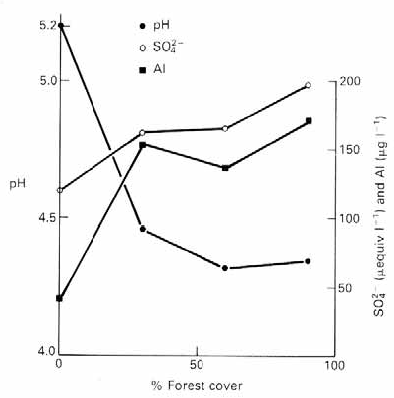
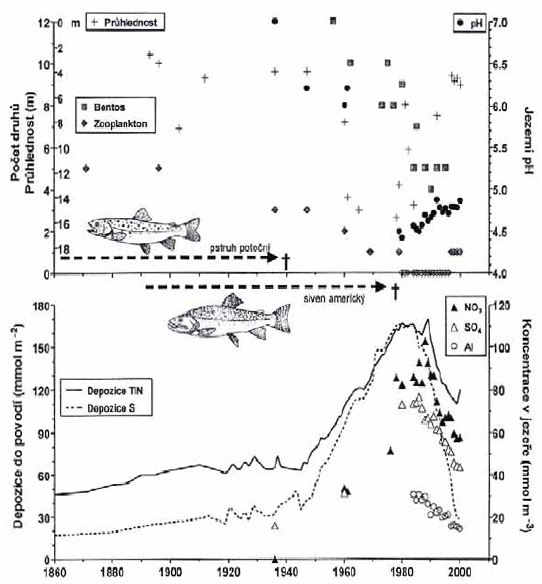
Obr. Vliv zalesnění na průměrné hodnoty pH, sírany a hliník v tocích ve zkoumaných povodích ve Skotsku Dlouhodobé a krátkodobé změny v kyselostiOkyselování probíhá dlouhou dobu skrytě a jeho příznaky se projevují teprve s odstupem času. Proto je vhodné se zabývat i minulostí okyselených ekosystémů. Pokud nebudeme schopni alespoň kvalifikovaným odhadem rekonstruovat stav sledovaného ekosystému před začátkem okyselení, nebudeme mít srovnání se stavem, k němuž bychom se měli opět přiblížit. Nepřímo lze dřívější chemismus jezerních vod zkoumat pomocí vhodně datovaných vzorků z profilů jezerních sedimentů. Často používanou technikou je historická rekonstrukce pH pomocí stratigrafické analýzy subfosilních vzorků rozsivek a šupinatých chrysofyt (Dixit et al. 1988, Hartmann-Zahn 1991), přítomných v odebraných vzorcích sedimentů dna. Pražáková (1994) srovnáním stratifikace zbytků perlooček ve sloupci sedimentu s poznatky o úbytku zoplanktonu v Černém jezeru na Šumavě za posledních 100 let zjistila nápadný soulad distribuce zbytků Cladocer v sedimentu se známou historií zooplanktonu jezera. Ze šesti druhů perlooček v roce 1871 není nyní přítomen žádný. Důvod postupného ubývání sice není zcela jasný, ale jako nejpravděpodobnější příčina se zdá, že nepřítomnost perlooček v současnosti může být vysvětlena acidifikací jezera (pH 4.4-4.8, vysoká koncentrace hliníkových iontů). Přímých údajů o chemismu jezerních vod z období před výrazným nástupem antropogenní acidifikace (tedy před rokem 1950) je obvykle velmi málo. Příkladem u nás je např. sledování Černého a Čertova jezera na Šumavě, kde jsou k dispozici údaje o chemickém složení vody z období posledních téměř 100 let (Veselý 1987). Z porovnání historických a současných údajů o složení jezerních vod vyplývá, že pH povrchové vody pokleslo během během posledních 50 let přibližně o 2 jednotky; okyselení však bylo méně výrazné v hlubších částech jezer (změna cca o 1 pH). Vzrůst koncentrací hliníku a berylia vyvolaný acidifikací Černého a Čertova jezera lze odhadnout asi na padesátinásobný; obsah dusičnanů vzrostl nejméně pětinásobně a obsah síranů se za posledních 50 let přibližně zdvojnásobil (Veselý 1987). Dlouhodobá měření chemických parametrů povrchových a podzemních vod a trendy v produkci oxidů síry a dusíku lze využít pro tvorbu matematických modelů simulujících dlouhodobý průběh okyselování. Hlavní složkou ekosystému, která určuje odolnost vůči antropogennímu okyselování, jsou půdy, a proto modely zahrnují zejména procesy okyselování půd a vod. Jedním ze středně komplexních modelů je např. model MAGIC (Model of Acidification of Groundwater In Catchments), který byl vyvinut v polovině 80. let v USA (Hruška et al. 1996). Kromě dlouhodobých změn acidity jsou ve vodních ekosystémech často patrné krátkodobé změny v pH vody. Fluktuaci jednodenních hodnot pH lze vysvětlit střídáním období s více či méně srážkami. Během období sucha nedochází k vyluhování půdy a pH vzroste - kyselé polutanty se usazují a kumulují na vegetaci. Naopak v deštivém období dochází k jejich vymytí a splachu do vod - zrychluje se evapotranspirace a s půdní vodou dochází k přísunu okyselujících sloučenin (Reuss et al., 1987). Podobně dochází k akumulaci kyselých depozic ve sněhu a jejich následnému rychlému vyplavení během tání sněhu. Tzv. episodické snížení pH v době tání sněhu bylo zjištěno v mnoha horských oblastech (např. Nilssen 1980, Van Sickle et al. 1997, Hämäläinen a Huttunen 1998, Henriksen 1989 in Mason 1981, Jacks et al.1986); snížení hodnoty pH v krkonošských tocích i pod 4,0 na jaře v době tání sněhu zaznamenali u nás např. Vávra (1982) a Kovalčík (1984). Tyto episodické výkyvy v pH vody mohou být značně škodlivé pro říční ekosystém……. Kimmel et al. (1985).
Obr. Episodické výkyvy v pH Rozsah acidifikacíV roce 1995 proběhlo sledování 5690 jezer ve státech severní části Evropy („Northern European Lake Survey“) Henriksen et al. (1998). Hodnocení ukázalo, že chemismus vod s výjimkou Dánska je charakterizován nízkou iontovou silou a nízkými koncentracemi dusíku a fosforu. Byly zjištěny všeobecné rozdíly v chemismu jezer mezi jednotlivými státy v důsledku rozdílné hydrologie, chemismu srážek, půdního krytu a vegetace. Existuje gradient v množství srážek od západu (západní Norsko, Skotsko, Wales) na východ (Finsko, Karélie) a od horských oblastí s tenkou půdou k zalesněným a oblastem se silnou půdou. Tyto dva faktory se odrážejí v chemismu jezer - nízké koncentrace bazických iontů (Ca, Mg, Na, K), alkalinity (HCO3-) a celkového organického uhlíku v západní části a vysoké koncentrace ve východní části. Přibližně u 22 000 jezer (tj. 14 % všech jezer v severní Evropě) je překročena kritická zátěž (critical load, CL) pro kyselost způsobenou sírou - (CL < 60 meq m-2 . rok-1). Tab. Procento a počet jezer s alkalinitou < 20 µeq.l-1 a s nízkým pH, ex Henriksen et. al. (1998)
Neutralizační a pufrační procesy v povodíV retenci přicházejících kyselých H+ iontů dominují v půdách i vodách při různém pH odlišné procesy. V povodí na bazických horninách je přicházející H+ nebo H+ produkované během půdní respirace neutralizováno rozpouštěním uhličitanu vápenatého nebo hořečnatého. Uvolněné HCO3 ionty odtékají s půdní vodou do vodních recipientů, zatímco vzniklé CO2 se ztrácí do atmosféry. Vysoký obsah HCO3 ve vodě na bazickém podloží, resp. obsahujícím materiál bohatý na CaCO3 tak neutralizuje přímé vstupy srážek o nízkém pH na vodní hladinu a nedochází k nápadnému snížení pH. V takových povodí je ANC téměř výlučně řízeno CO3/HCO3 systémem. Jestliže je však přísun H+ stále větší a dostupný CaCO3 v povodí omezen, progresívně zvyšující se frakce HCO3- je v podobě CO2 ztracena do atmosféry a HCO3 v odtocích a pH v jezerech v průběhu času začnou klesat. Senzitivní povodí HCO3- vzniklé zvětráváním tvrdých vyvřelých hornin nedostačuje k tomu, aby řeky a jezera byly dostatečně odolné k acidifikaci. H+ ionty v neacidifikovaných srážkách jsou primárně zachyceny v půdě povodí a neutralizovány kationtovou výměnou a jen málo jsou uvolňovány do odtoku. Část H+ je rovněž zachycena a odstraněna v procesech rozpouštění hydroxidů a oxidů hliníku a SiO2 obsažených v jílovitých minerálech, které vznikají zvětráváním silikátů. Jiné H+ ionty mohou být vyměněny za kationty na půdních částicích. Uvolněné Al ionty nahrazují Ca, Mg a jiné bazické kationty na negativně nabitých koloidech jílu a humusových částicích půdní matrix – tyto kationty se dostávají do odtékající vody. Rozsah, v jakém půdy na vyvřelých horninách slouží jako pufr a chrání odtékající toky a jezera je funkcí
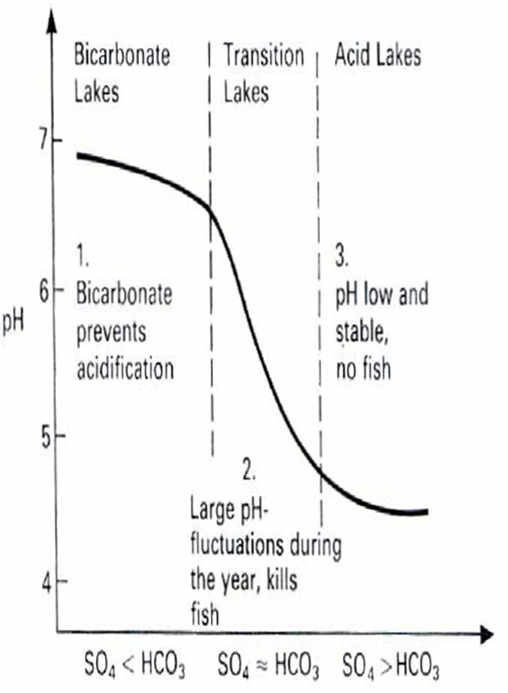
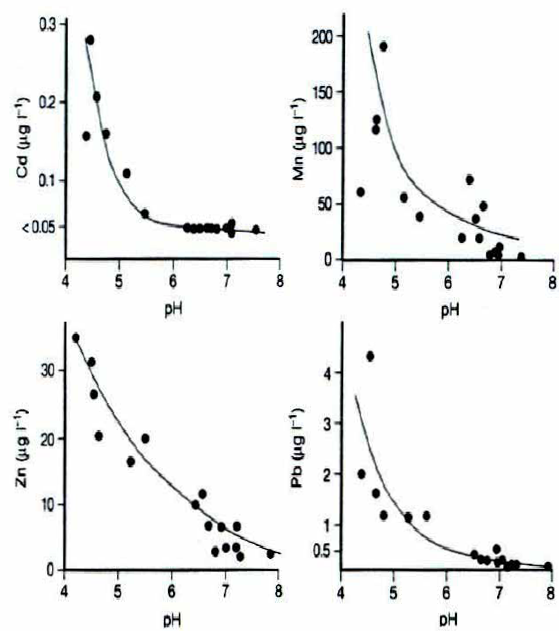
Pokud se přísun silných kyselých aniontů (primárně SO4 a NO3) během acidifikace zvyšuje, potom musí z důvodu zachování vyrovnaného iontového náboje ekvivalentně docházet ke zvýšenému vyplavování kationtů. Chemismus vodyK zachycení aktuálního stavu acidifikace se používá Henriksenova empirického modelu acidifikace. Teoretickým základem modelu je představa acidifikace jako titrace slabého roztoku hydrouhličitanu silnou kyselinou. Pufrační (neutralizační) kapacita vodního prostředí je determinována koncentrací hydrogenuhličitanových (bikarbonátových) iontů: H+ + HCO3 -® H2O + CO2 Obr. Pufrační (neutralizační) kapacita vodního prostředí Výsledek tohoto procesu závisí na původní koncentraci HCO3 (tj. na původní = preacidifikační alkalinitě) a na množství přidané kyseliny (tj. na přírůstku SO4 v jezerní vodě). Původní alkalinita je určována chemickým zvětráváním podloží a biologickou aktivitou, zatímco zdrojem silné kyseliny jsou kyselé srážky. Model udává hodnoty pH jezer na základě interakce dvou parametrů. Vnitřním parametrem je rychlost zvětrávání a vnějším rychlost přísunu silné kyseliny. Vnitřní parametr lze získat měřením současných koncentrací Ca, resp. sumy Ca+Mg, neboť koncentrace těchto iontů a koncentrace HCO3 si jsou ve vodách nezasažených acidifikací přibližně rovny a koncentrace Ca se v průběhu acidifikace výrazně nemění, někdy však vzrůstá. Vnější parametr získáme z koncentrace SO4 v jezerech (samozřejmě za předpokladu, že veškeré zvýšení koncentrace SO4 v jezerech proti původním hodnotám je způsobeno kyselými srážkami). Obecné změny, ke kterým dochází během acidifikace jezer je znázorněn na obr. V procesu acidifikace můžeme rozlišit tři fáze: I. HCO3- jezera: alkalinita se snižuje, ale pH neklesá pod 5.5 Voda má vysoký obsah hydrogenuhličitanů, které neutralizují vzrůst H+ iontů – území má dobrou pufrační kapacitu. V tomto stádiu nedochází k výraznému trvalému poklesu pH vodního prostředí, ubývá však hydrogenuhličitů a v důsledku toho klesá alkalinita a snižuje se pufrační kapacita prostředí. Nedochází ke změnám ve složení biocenóz. II. přechodná jezera: alkalinita je nulová, pH silně kolísáVýrazný pokles bikarbonátů, neutralizace H+ iontů nestačí. pH je nestabilní, během roku dochází ke značným výkyvům v pH vody a masovému hynutí ryb. Čím větší je přísun H+ iontů, tím delší je kyselé období jezera. Druhé stádium acidifikace nastává, když po určité období roku mají povrchové vrstvy vody pH 5.5 III. kyselá jezera: pH klesá k hodnotě 4.5, koncentrace hliníku a těžkých kovů vzrůstají Reakce vody je trvale stabilizována na hodnotu okolo 4.5, zatímco koncentrace hliníku a těžkých kovů nadále vzrůstají. Huminové látky a ionty hliníku začínají působit jako pufr proti další acidifikaci. Ionty hliníku (Al3+) působí v mírně kyselých vodách jako kyselina, protože s vodou vstupují do reakce Al3+ + 3 H2O = Al(OH)3 + 3H+ Při další acidifikaci Al(OH)3 vstupuje do další chemické reakce s H+ ionty podle reakce: Al(OH)3 + 3H+ ® Al3+ + 3 H2O tím neutralizuje a brání dalšímu poklesu pH vody. Tímto procesem narůstá v acidifikovaných povrchových vodách obsah hliníkových iontů. Hliník má silný toxický účinek na mnoho organismů, působí masové hynutí rybí obsádky jezer (tzv. hliníková otrava jezer). Tento třetí stupeň acidifikace výrazně mění charakter ekosystému, který je charakteristický absencí ryb, sníženou druhovou diverzitou a abundancí živočichů i rostlin. Průvodním znakem je stav zdánlivě čisté vody s velkou transparencí (průhledností), dominantními rostlinami se obvykle stávávají rašeliníky rodu Sphagnum. Obr. Z nomogramu je patrné, že při přibližně stejných koncentracích SO4 v jezerech je citlivost každého jezera k acidifikaci i současný stav jeho acidifikace, a tedy i hodnota pH, funkcí koncentrace Ca. Výskyt těžkých kovů, hliníku a vápníku ve voděAcidifikace půdy zvyšuje rozpustnost a vyluhování kovů do povrchových vod, nejvíce hliníku, kadmia, železa, manganu a rtuti. Bylo prokázáno, že při snížení hodnoty pH se zvyšuje toxicita hliníku a stejný jev se předpokládá pro další těžké kovy, jako jsou rtuť, kadmium, měď a olovo. Naopak jejich toxicita může být snížena vyšší koncentrací vápníku nebo huminových látek (Herrmann, 1993). Hlavně rozpuštěné huminové látky jsou schopny vytvářet komplexy nebo cheláty s těžkými kovy a snižovat tak jejich toxicitu (Gjessing, 1979 in Lingsten, 1991). Hliník (Al)- v rozpuštěné formě se hliník v kyselých vodách pH < 4,5 vyskytuje jako hexaaquahlinitý kation (Rath, 1990; Pitter, 1999). Při nízkém pH je hliník schopen tvořit komplexy s huminovými látkami a tím snižovat svoji toxicitu. Avšak tyto komplexy mohou zvýšit jeho pohyblivost a přístupnost a tím naopak zvýšit jeho nepříznivý vliv (Herrmann et al., 1993). Při snížení pH se zvyšuje koncentrace Al ve vodě (např. Smith et al., 1990; Herrmann et al., 1993; Orendt, 1998). Maximální koncentrace hliníku bývají naměřeny v době tání sněhu, kdy také bývají epizodicky nejnižší hodnoty pH. Vápník (Ca) najdeme v málo mineralizovaných vodách jako ion Ca2+ (Pitter, 1999). Obr. S klesajícím pH roste koncentrace těžkých kovů ve vodách vlivem snížené hodnoty pH dochází ke: zvýšení hodnot vodivosti o 10 mS/cm zvýšení koncentrace síranů s klesající nadmořskou výškou vzrostlo množství těžkých kovů ve vodě - mědi, olova a kadmia zvýšení množství hliníku a pokles koncentrace vápníku
snížená hodnota pH má za následek: snížení hodnoty indexu diverzity zvýšení indexu dominance (max. relativní četnost u acidobiontního druhu Eunotia exigua snížení hodnoty indexu druhové vyrovnanosti na nejkyselejších lokalitách dominanci acidofilních a acidobiontních indikačních skupin rozsivek dle odvozeného pH lze sledované toky zařadit do skupiny stále kyselých (permanently acidic), dle naměřeného pH do skupiny periodicky okyselovaných (periodically acidic) snížená hodnota pH ovlivňuje: zvýšení podílu acidobiontních druhů (Eunotia exigua), nejvíce v nižších nadmořských výškách zvýšený podíl acidofilních druhů v jarním odběru fluktuace pH na podzim - společný výskyt acidofilních a acidobiontních druhů Jedním z důsledků acidifikace je rovněž pokles koncentrace rozpuštěného organického uhlíku (DOC), pozorovaný v mnoha jezerech a řekách. Vliv kyselých srážek (acidifikace) na vodní ekosystémy Acidifikace a transparenceTransparence vody se zřetelně po okyselení zvyšuje, což je způsobeno částečně zvýšenou koagulací barevných rozpuštěných organických složek (DOM). Koagulace je způsobena zčásti uvolněným hliníkem, zčásti zvýšeným odbarvením a oxidací barevných složek. Experimentálně bylo zvýšení transparence ověřeno na jezerech s huminovou vodou v USA (Schindler et al. 1996). Během desetileté periody okyselování H2SO4 pokleslo pH jezerní vody z 6.0-6.7 na 4.5, v jezeru se silně zvýšila průhlednost a DOC pokleslo ze 7.2 mg.l-1 na ~ 1.5 mg.l-1. Zvýšení transparence má zcela zásadní důsledky. Umožňuje zvýšené pronikání světelné energie, které snižuje zahřívání vody v povrchové vrstvě, a zvyšuje tak hloubku termokliny a hloubku, ve které je možná fotosyntéza fytoplanktonu a bentických řas. Avšak zvýšení transparence s sebou nese i problém zvýšené penetrace ultrafialového záření. V experimentálně okyseleném jezeru 302S se hloubka vody, do které proniklo ještě 1 % UV záření, zvýšila 9x z ~ 0.3 m na 2.8 m (Schindler et al. 1996). Doposud však zůstává nejasné, do jaké míry zvýšené pronikání UV záření a změny ve stratifikaci mohou přispívat ke změnám v biotě, pozorované během acidifikace jezera. Vliv acidifikace na biotu Ačkoliv existuje relativně rozsáhlá literatura zabývající se vlivy acidifikací vodních ekosystémů na biotu, většina z nich byla získána pozorováním, která neumožňují jednoznačně definovat příčiny a mechanismy působení. To platí zejména v případě ryb, kde byla provedena celá řada laboratorních pokusů zaměřených na studium fyziologické odezvy ryb na vyvolané okyselování prostředí. Ačkoliv laboratorní výsledky jsou obvykle jednoznačné a umožňují identifikaci klíčových odpovědných mechanismů, je doposud nemožné pomocí těchto mechanismů vysvětlit změny pozorované ve složení společenstev v přírodních podmínkách. Přítomnost nebo absence konkrétního druhu v přírodě může být totiž ovlivněna nejen samotnou aciditou, ale i dalšími stresory, jako např. reaktivním hliníkem a jinými stopovými kovy, sezónními změnami v rozpuštěném organickém uhlíku (DOC), přísunem potravy, predací, kompeticí o zdroje a jinými interakcemi mezi druhy. Biologická odezva na acidifikaci se může vyskytovat v širokém rozpětí "stupně organizace", od subbuněčných až po globální. Ekologické důsledky acidifikace na potoky a řeky zahrnují vlivy na populace (velikost, denzita), společenstva (druhová bohatost, relativní abundance, trofická struktura), ekosystémové procesy (produkce, transformace nutrientů) a stejně tak velké krajinné a globální procesy (Hildrew a Ormerod 1995). Důsledky jsou výsledkem přímého nebo nepřímého vlivu acidifikace. Acidifikace je komplexní chemický fenomén zahrnující snížení alkality a vzrůst koncentrace hliníku (a často dalších kovů) a koncentrace vodíkového iontu. Některé z těchto chemických změn mohou mít přímý vliv na vodní biotu. Tyto vlivy mohou být letální nebo subletální a mohou být jednoznačně považovány za příčínu nejvíce změn pozorovaných ve vodních systémech. Přímé vlivy acidifikace byly dobře posány pro vodní makrofyta (Farmer 1990), bezobratlé a ryby (Morris et al. 1989) Daleko méně jsou známé pro řasy, menší bezobratlé a mikroby. Nepřímé vlivy acidifikace mohou působit pouze jako důsledek přímého vlivu. Můžeme rozlišit tři hlavní typy nepřímých vlivů (Hildrew a Ormerod 1995). První, kde je predátor senzitivní k acidifikaci a abundance jeho kořisti, fyziologicky rezistentní k acidifikaci a normálně regulovaná predátorem, může vzrůst. Tento "top-down" efekt se vyskytuje např. tam, kde absentují ryby a abundance jejich kořisti se zvýší. Redukce tlaku spásání je dalším příkladem "top-down" efektu a jeho výsledkem je vzrůst řasové biomasy. Druhý typ nepřímého vlivu se může vyskytovat tam, kde taxony senzitivní k aciditě jsou významnou potravou nebo kořistí v potravních vztazích pro druhy nepřímo ovlivněné acidifikací. To je ukázka "bottom-up" efektu a dobrým příkladem je vymizení skorce z kyselých potoků via redukci jeho potravy, která je obvykle dominantně tvořena druhy bezobratlých a ryb senzitivních na okyselení. Třetí možný nepřímý vliv je, že kompetiční vztahy mezi druhy by mohly být změněny rozdílnou náchylností k acidifikaci ("horizontální efekt"). Tento typ je zvláště sporný, protože všeobecně existuje kontroverze okolo významu interspecifických kompeticí v tocích. Bylo provedeno několik pokusů testovat tuto hypotézu, např. např. kachňata na acidifikovaných a bezrybích jezerech v Kanadě přežívala a rostla lépe než na jezerech s rybami, pravděpodobně v důsledku snížené kompetice o kořist v podobě větších bezobratlých. Je zřejmé, že trofický řetězec v acidifikací narušených ekosystémech je obvykle jednodušší, protože dochází ke ztrátě senzitivních druhů, ačkoliv biomasa společenstva zůstává často nezměněna. K výrazné ztrátě druhové bohatosti (diverzity) dochází zpravidla tehdy, když pH poklesne dlouhodobě pod 6 a voda vykazuje ANC < 50 meq.l-1, ačkoliv ne všechny taxonomické skupiny jsou ovlivněny stejně. (Kalff 2002). Typický příklad vývoje společenstva acidifikovaného jezera uvádí Nilssen (1980). Během periody 1965-1975 došlo u jezer v jižním Norsku k poklesu pH o půl stupně (z 5.9 na 5.4), vodivost se zvýšila z 23 na 29 µS/cm a celková tvrdost ze 3.0 na 4.5 mg/l. Tato jezera jsou acidifikována především kyselými srážkami a vzhledem ke geologickému složení mají velmi nízkou pufrační kapacitu. Vymizely ryby, Chaoborus i Daphnia. Se vzrůstající acidifikací se planktonní společenstvo změnilo ze systému ovládaného predací rybami (pstruh a okoun jako dominantní druhy) na systém ovládaný bezobratlými predátory s dominantní buchankou rodu Heterocope a pelagickými klešťankami (Corixidae). Pelagický zooplankton je primárně tvořen litorálními druhy: Bosmina longispina, Diaphanosoma brachyurum, Eudiptomus gracilis a Heterocope saliens. Nejsou zde žádní plži a pijavky, pouze jepice rodu Leptophlebia. Hojné jsou klešťanky a brouci. Mikrobiální aktivita a dekompoziceAčkoliv doposud víme velmi málo o druhovém složení, lze považovat za prokázané, že acidifikace vykazuje pouze malý, nebo žádný vliv na abundanci heterotrofních baktérií v planktonu. Rovněž studie zaměřené na příjem kyslíku bentickými bakteriemi, obrat glukózy a bakteriální abundance neukazovaly žádný pokles se zvyšující se acidifikací. V důsledku absence filtrátorů (perloočky) dochází zpravidla v přirozeně kyselých nebo acidifikací postižených vodách k rozvoji mikrobiální smyčky s dominancí planktonních flagelát a nálevníků. Jedním z procesů, které jsou velmi citlivé k acidifikaci je dekompozice. Je např. známo, že toky dlouhodobě zatěžované kyselými důlními vodami kumulují velké množství nerozloženého nebo částečně rozloženého rostlinného materiálu (Harrison 1958). Rovněž Grahn et al (1974) pozorovali zvýšenou akumulaci hrubého detritu (listí, makrofyta) na dně acidifikovaných švédských jezer. Při srovnání dvou toků ovlivněných kyselými odtoky po srážkách a tání sněhu Kimmel et al. (1985) zjistili, že na rozdíl od prvního toku, který byl relativně dobře pufrován, dekompozice ve druhém toku byla signifikantně pomalejší. Snížený rozklad organického materiálu je způsoben zřejmě kombinací inhibice mikrobiálního (Hall et al. 1980) a makrobentického společenstva (Otto & Svensson 1983), pravděpodobně v důsledku toxicity těžkých kovů (Webster & Benfield 1986). V tocích s pH 4.6 – 5.4 byla dekompozice 5 až 20x pomalejší než v tocích s pH 5.6 – 7.1 (Minshal a Minshall 1978). Podobně Carpenter et al. (1983) sledovali vliv kyselých důlních vod na dekompozici makrofyt v nádrži. Srovnávali kontrolní stanoviště (pH = 6.3); experimentální stanoviště s naředěnými kyselými vodami (pH = 5.7) a stanoviště blízko zdroje kyselých vod (pH = 3.7). Výsledkem bylo zjištění, že 1) mikrobiální aktivita a proces dekompozice byly inhibovány v blízkosti zdroje a 2) stupeň inhibice klesal s nařeďováním kyselých vod v nádrži. Hlavním důvodem inhibice byly změny ve struktuře mikrobiálního společenstva způsobené změnou kvality vody v důsledku působení kyselých důlních vod. Změny v kvalitě vody zahrnují: (1) zvýšenou aciditu (snížené pH) a (2) zvýšené koncentrace těžkých kovů jako např. olovo. Oba tyto faktory působí na mnoha lokalitách synergisticky. Bonacina et al. (1991) uvádějí, že snížený rozklad listí olše (Alnus glutinosa) v antropogenně kyselém jezeru je způsoben interakcí mezi pH a rozpustostí toxických kovů a jejich vlivem na mikro- a makrobentos. Obr. Srovnání dekompozice listí v acidifikovaném a neacidifikovaném toku Pomalý rozklad autoři vysvětlují zejména změnami v abundanci a biomase skupiny bezobratlých drtičů a kouskovačů (shredders) , kteří se podíleli na dekompozici. Pouze málo organismů kolonizovalo materiál určený pro rozklad a mezi nimi shredders byli vzácní. Přitom význam této funkční skupiny při rozkladu byl zmíněn mnoha autory. Vliv sníženého pH na mikrobiální společenstvo, podílející se na dekompozici není zatím spolehlivě doložen. Bakteriální a houbové počty nejsou obvykle v acidifikovaných vodách nižší, jsou publikovány případy jejich snížení, zvýšení a malého rozdílu s klesajícím pH (Hildrew a Ormerod 1995). Akvatické mikroskopické houby (Hyphomycetes) jsou dominantní mikrobiální skupinou, která se podílí na primární kolonizaci rozkládajícího se listí. Tyto houby preferují všeobecně mírně kyselé až neutrální toky. Jejich druhová diverzita je nejvyšší při pH 5-7 a klesá v alkalickém pH. Předpokládá se proto, že v okyselených vodách nastává posun v dominanci od baktérií k houbám, které se budou podstatnou měrou podílet na dekompozici organického materiálu , avšak ve srovnání s bakteriemi bude jejich mineralizační kapacita zřejmě nižší (Grahn et al. 1974). Frankenhuyzen & Geen (1986) zjistili, že listí olše kolonizované při pH 4 vykazovalo skutečně vyšší biomasu hub a bakteriální abundanci než listí kolonizované při pH 6. Rosset & Bärlocher (1985) pěstovali deset druhů akvatických hyphomycet na umělém substrátu dokonce při pH 4-5. Výjimka z tohoto pravidla byla zjištěna v rašelinných potocích, kde diverzita hyphomycet klesala s klesajícím pH. Rašelinné toky jsou všeobecně zabarvené huminovými látkami, které mohou být toxické v kyselých podmínkách. Bärlocher a Petersen (1988) předpokládali, že hyphomycetes by měly být zvýhodněné v mírně kyselém prostředí v huminovém toku, zatímco vápnění a zvýšení pH by mělo poskytnout méně vhodné podmínky. Výsledky však zatím tento předpoklad nepotvrdily. Rozdíly mezi oběma toky nebyly zjevné. FytoplanktonU řasové flóry je zcela zřetelný rozdíl v druhovém složení mezi kyselými a neutrálními vodami a tyto rozdíly jsou základem pro biomonitoring a rekonstrukci pH vody s použitím rozsivek. Acidifikace je provázena snížením počtu druhů planktonních řas, zejména ze skupiny zelených řas (Chlorophyceae). Vody s pH < 5 mají méně než 10 druhů fytoplanktonu a dominantní skupinou jsou zpravidla obrněnky (Dinoflagellata), Stuchlíková et al. 1985. Navzdory poklesu druhové bohatosti nebyl zatím podán jednoznačný důkaz, že by došlo rovněž k poklesu biomasy a produkce fytoplanktonu. Snížení množství sestonu v jezerech s pH 5-6 a jeho opětovné zvýšení v jezerech s pH menším jak 5 je obecným jevem provázejícím acidifikaci. Lze ho vysvětlit schopností hliníku srážet fosfor, která je největší v rozmezí pH 5-6, zatímco při pH 4.5 je možné v jezerech najít vyšší koncentraci fosforu než při pH 6-7 (Stuchlíková et al. 1985). Fott et al. (1994) zjistili, že fytoplankton šumavských jezer je velmi chudý a podobný, dominantní skupinou jsou flageláta. Druhové složení je podobné jiným acidifikovaným jezerům. Srovnání současného stavu se starými nálezy značí, že fytoplanktonní druhy vyskytující se v oligotrofních jezerech senzitivních k acidifikaci jsou schopné přežívat, pokud jsou tato jezera acidifikována (Fott et al. 1994). Bentické řasyV tocích je situace poněkud odlišná. V perifytonu silně kyselých toků (pH < 5) jsou dominantní rozsivky a do určité míry zelené řasy a vláknité řasy (Stokes 1981). Charakteristickými rody rozsivek pro kyselé vody jsou Eunotia a Tabellaria,zatímco v méně kyselých vodách (pH 5.7 a více) dominují zlativky (Chrysophyta) a sinice, často doprovázené rozsivkami rodů Achnanthes, Gomphonema a Cymbella. Vliv kyselosti na biomasu a produkci epilitických řas je méně zřetelný - byly publikovány údaje o zvýšené nebo snížené biomase a produkci v kyselých vodách ve srovnání s neutrálními. Vyšší primární produkce zjištěná v kyselých tocích, je pravděpodobně důsledkem snížení spásání perifytonu bezobratlými (Mulholland et al. 1986). Podobně byl zjištěn vzrůst biomasy perifytonu i v jezerech, kde jsou dominantní především extrémně husté nárosty (tzv. algal mats) vláknitých zelených řas na povrchu litorálního sedimentu a mrakům podobné chuchvalce vláknitých zelených řas v litorální zóně a mezi makrofyty. Tyto mrakovité chomáče jsou nejhojnější při poklesu pH pod 5.6 a vymizí při vzestupu pH nad 5.8. Kromě absence bezobratlých spásačů je důvodem enormního rozvoje těchto bentických řas zřejmě zvýšená fotosyntéza v důsledku zvýšené transparence a schopnost snášet nižší koncentrace anorganického uhlíku ve vodě (Kalff 2002). Makrofyta Složení makroflóry se liší značně podle hodnoty pH. Ormerod et al. (1987) se domnívají, že přítomnost nebo absence indikátorových druhů může být použita při hodnocení acidifikace toků. Přítomnost játrovek Scapania undulata a Nardia compressa a absence ruduchy rodu Lemanea indikuje vody s rozpětím pH od 4.9 – 5.2. Přítomnost mechu Fontinalis squamosa a absence Lemanea značí pH 5.6 – 5.8 a přítomnost obou pH 5.8 – 6.2. Říční voda bude mít pH s největší pravděpodobností vyšší než 6.2, pokud rod Lemanea bude přítomen a Fontinalis squamosa bude absentovat. Při pH vody 4 a méně a současném vymizení většiny fytoplanktonu se zvyšuje průhlednost vody a dominantními rostlinami se obvykle stávávají rašeliníky rodu Sphagnum. Buněčné stěny rašeliníku mají výjimečnou schopnost selektivně adsorbovat bazické ionty a uvolňovat vodíkové ionty, takže postupně vzrůstá kyselost okolní vody, která může dosáhnou hodnoty až okolo pH 3 (Soldán 1998). Acidita (v kombinaci s málo dostupným kyslíkem také tlumí přežívání řady mikroorganismů, a to včetně dekompozitorů, takže se organický materiál postupě kumuluje a vytváří se rašelina (definovaná jako biogenní sediment s obsahem více než 50 % spalitelných látek v sušině). Mocnost rašeliny přitom může dosahovat až několika metrů. Že většina rašeliníků rodu Sphagnum roste v neobvykle kyselých podmínkách a že rostlinky rašeliníku přispívají k produkci těchto podmínek je známo dlouhou dobu. Proces acidifikace u rašeliníků byl popsán jako kationtová výměna (Clymo & Hayward 1982). Místem kationtové výměny jsou pravděpodobně karboxylové skupiny (COO-) na dlouhém polymerním řetězi obsahujícím kyselinu uronovou. Kyselinu uronovou si můžeme představit jako cukr, ve kterém byl CH2OH v bočním řetězci na C6 nahrazen COOH. Existuje velmi těsná korelace koncentrace reziduí uronové kyseliny v polymerech s kationtovou výměnnou kapacitou a regrese výměnné kapacity na uronové kyselině je téměř přesná jako vypočtená. Uronová kyselina tvoří přibližně 10 % sušiny u ponořeného druhu S. cuspidatum a až 30 % u S. fuscum, rostoucího na bultech. Nejvyšší acidita v porostech rašeliníků je v létě, kdy je maximální růst rostlinek, Druhy rostoucí na bultech mají větší výměnnou kapacitu a mohou tedy způsobovat více kyselé podmínky. Obecně se předpokládá, že kyselé deště a všeobecná acidifikace vod budou favorizovat růst rašeliníků, ale není tomu tak. Sphagnum téměř vymizelo z velkých oblastí South pennines, kde bylo hojné před stovkami let. Příčinou je toxické působení síry, zejména bisulfitu HSO3-, který poškozuje rašeliník i při nízkých koncetracích. Tento fakt byl potvrzen pokusy s růstem rašeliníku v přírodních podmínkách, který byl podstatně redukován příležitostným ošetřením roztokem HSO3-, který simuloval přírodní episodické případy kyselých dešťů (Clymo & Hayward 1982). Poměrně hodně druhů vodních makrofyt je rezistentních ke kyselosti, proto má postupující acidifikace na ně pouze malý vliv. Může však docházet k posunu v relativním významu jednotlivých druhů. Např. v některých skandinávských jezerech byly lobelky (Lobelia) a šídlatky (Isoetes) – typické pro neacidifikovaná jezera s měkkou vodu – nahrazeny rašeliníky (Sphagnum). BezobratlíZcela jednoznačné vlivy acidifikace byly prokázané na populacích a společenstvech vodních bezobratlých. Acidifikované toky mají pouze několik druhů, především v důsledku redukce "senzitivních taxonů" - jepic, korýšů a měkkýšů, ale i pakomárů a chrostíků. Několik tolerantních druhů, jako některé pošvatky, pakomáři a jeden či dva druhy chrostíků perzistují a mohou mít v podmínkách okyselení i větší abundanci. Menší bezobratlí, včetně bentických klanonožců a perlooček, jsou rovněž druhově chudší v acidifikovaných tocích a druhy, které perzistují, mohou mít opět aktuálně vysokou abundanci. Málo je zatím známo o vlivu na jiné taxony menších bezobratlých, jako jsou Nematoda, Ostracoda, Rotifera a Protozoa Zooplankton V jezerních ekosystémech byla značná pozornost věnována změnám ve složení zooplanktonu v závislosti na zvyšující se acidifikaci. Obr. ukazuje vztah mezi druhovou bohatostí fauny korýšů a pH. Počet druhů rapidně klesá se vzrůstající kyselostí, přičemž žádný vztah nebyl zjištěn ve vztahu k vápníku. Z grafu dále vyplývá, že hodnoty pH 5 a nižší jsou řídícími faktory společenstva v kyselých vodách, zatímco při hodnotách nad pH 5 působí pravděpodobně jiné faktory (Fryer 1980). Mezi běžné dominantní druhy kyselých jezer Severní Ameriky patří Diaptomus minutus, Bosmina longirostris a vířník Keratella taurocephala – tyto druhy často představují celkové zooplanktonní společenstvo. Eudiaptomus gracilis, Eubosmina longispina a Keratella serrulata jsou typickými druhy kyselých skandinávských jezer. Naopak druhy rodu Daphnia a Cyclops, jsou většinou řídce zastoupené nebo zcela chybí ve vysoce acidifikovaných vodách. Obr. Vztah mezi druhovou bohatostí planktonních korýšů a pH Změny ve složení zooplanktonu vlivem acidifikace se vysvětlují působením celé řady faktorů. Vysoké koncentrace iontů H+ a kovů způsobují fyziologický stres. Ten bývá nejvýznamnější v silně kyselých prostředích, kde bylo společenstvo redukováno na pouhých několik druhů a posun v kompetiční schopnosti (fitness) favorizuje ty druhy, které jsou nejvíce tolerantní k aciditě, nejčastěji generalisty. Havens et al. (1993) studovali 6 běžných druhů zooplanktonu, které se vyskytují v jezerech Ontaria v Kanadě. Zjistili velké kolísání v jejich distribuci podél gradientu pH (Obr.) Senzitivita druhů k pH byla následující (od nejvíce senzitivního druhu k nejméně): Daphnia galeata mendotae, Daphnia retrocurva a Skistodiaptomus oregonensis > Diaphanosoma birgei > Mesocyclops edax > Bosmina longirostris. Obr. Senzitivita druhů k pH byla následující (od nejvíce senzitivního druhu k nejméně): Daphnia galeata mendotae, Daphnia retrocurva a Skistodiaptomus oregonensis > Diaphanosoma birgei > Mesocyclops edax > Bosmina longirostris Toto zjištění bylo potvrzeno i laboratorními pokusy toxicity s různými hodnotami pH. Z výsledků práce, ale i jiných vyplývá, že pH samo o sobě je hlavním abiotickým faktorem kontrolujícím pelagickou potravní síť a k vysvětlení korelace přítomnosti druhu s pH v přírodních podmínkách není potřeba studovat další faktory jako např. Al, organický uhlík atd. Fott et al. (1994) vysvětlují recentní absenci zooplanktonu v acidifikovaných jezerech hladověním, které následuje po ultraoligotrofii. Jestliže jezero je acidifikováno na hodnotu pH 5-6, ztrácí fosfor vlivem srážení fosfátů s hliníkem. Tato jezera pak mají i nejnižší koncentrace chlorofylu. Jiným faktorem je posun ve struktuře fytoplanktonu, např. směrem k nejedlým druhům, dále změny v dostupnosti bakterioplanktonu a detritu a změny ve společenstvu predátorů, včetně eliminace ryb. Havens a DeCosta (1985) např. zjistili, že ve srovnání s kontrolou, která byla vystavena predaci buchankou Mesocyclops edax, v acidifikovaném pokusu abundance a průměrná velikost těla perloočky Bosmina longirostis vzrůstala v důsledku poklesu abundance predátora. Převaha menších druhů ve společenstvu acidifikovaných vod je poněkud překvapivá, neboť se předpokládalo, že vymizení ryb, které se živí přednostně větším zooplanktonem, bude favorizovat větší druhy. Avšak některé planktivorní druhy ryb (např. okoun) jsou tolerantní k okyselení a stávají se hojnými, zejména poté co z prostředí vymizí jejích senzitivní predátoři. Rovněž dravé larvy koreter (Chaoborus), které jsou také málo ovlivněné acidifikací a živí se středně velkým zooplanktonem a juvenilními stádii velkých druhů, se mohou stát velmi hojnými v absenci rybích predátorů. Inverzního vztahu mezi abundancí ryb a koretrami využívají paleolimnologové k detekci vymizení ryb po acidifikaci, neboť části kousacího ústrojí koreter jsou dobře zachovalé v sedimentech studovaných jezer (Uutala et Smol 1996) ZoobentosTato skupina bezobratlých má mnoho druhů, které jsou citlivé ke snížení pH. Mezi korýši je např. blešivec Gammarus lacustris v norských jezerech vzácný při pH < 6,6 a chybí při pH < 6,0. Blešivci, raci a další bezobratlí mají při nízkém pH problém s udržení pevnosti svého vnějšího krunýře. Plži z vod vymizí, když pH klesne pod 5,2-5,0 a téměř žádný CaCO3 není k dispozici tvorbu ulity. Naopak beruška vodní (Asellus aquaticus), která je v norských vodách hojná při pH 4,4-4,6, vymizí až při pH nižším než 4,2. Měkkýši jsou obecně nejcitlivější skupinou vzhledem k acidifikaci a některé druhy z vody vymizi již při pH > 6. Z hmyzu jsou k okyselení odolné např. larvy muchniček (Simuliidae), vírníci (Gyrinidae), klešťanky (Corixidae) a vážky (Zygoptera), pravděpodobně v důsledku absence rybích predátorů. Naopak některé druhy jepic, pošvatek a chrostíků jsou náchylné k acidifikaci a rychle z vod postižených okyselením vymizí (Kalff 2002), ačkoliv i zde existují značné rozdíly ve výsledcích mezi studiemi. Rodová bohatost a diverzita bentických bezobratlých je zpravidla korelována s pH, ale nebyla podle Smith et al. (1990) signifikantně nižší na okyselených lokalitách než na jiných, zatímco jiné studie (Hall et al. 1980, Kimmel et al. 1985, Mackay & Kersey 1985, Townsend et al. 1983, Simpson et al. 1985) uvádějí, že toto snížení signifikantní bylo. Rovněž na pokles denzity s poklesem hodnoty pH existují rozporné názory. Simpson et al. (1985) a Smith et al. (1990) zjistili, že celková denzita bezobratlých neklesla na kyselých místech ve srovnání s jinými lokalitami, naopak Hall et al. (1980), Townsend et al. (1983) a Kimmel et al. (1985) uvádějí pokles denzity. Mackay & Kersey (1985) rozdělili toky do 3 skupin podle pH a společenstva: 1) nejvíce kyselé toky (roční rozpětí pH 4,3-4,8) a zcela chybí jepice; 2) 5,0-6,3 a jepice i pošvatky, většinou shredders, nejdominantnější a i největší diverzitu mají chrostíci; 3) 5,3-6,7 - bohatší a více vyrovnané společenstvo, s několika shredders, více kolektorů. Necitlivějším obdobím vodních bezobratlých k nízkému pH je perioda výletu imag (emergence). Nejvíce citlivé jsou jepice, méně pošvatky a vážky a nejméně chrostíci. (Bell 1971). Snížení druhové diverzity jepic nebo vymizení bylo pozorován více autory (Hall et al. 1980, Harriman & Morrison 1982, Sutcliffe a Carrick 1973, Mackay & Kersey 1985). Není dosud známo, do jaké míry pozorované změny v systému jsou způsobeny vlivem toxicity nízkého pH (tedy vzrůst H+ iontů) a vlivem kovů, nebo nepřímými vlivy způsobenými změnou trofických vztahů. Důležitým mechanismem vedoucím ke změně společenstva by mohl být i narušený koloběh detritové energie, protože rozklad alochtonního materiálu, zejména listí, představuje zejména v horních částech toku hlavní dráhu toku energie. Ačkoliv několik studií ukázalo snížení rozkladu v tocích vystavených kyselým srážkám, málo informací je o dostupných ekologických důsledcích z pohledu toku energie (Dangles & Guérold 1998). Absenci dvou druhů jepic Baetis muticus a Baetis rhodani v kyselých vodách (pH 4,8-5,2) potoků zjišťoval Willoughby (1988). K vysvětlení této absence bylo použito terénních i laboratorních pokusů. B. muticus nemohla tolerovat kyselou vodu, protože využívá jako potravu mikrobiální společenstva na rozkládajícím se listí - avšak dobře se rozkládající listí v kyselých vodách chybělo. Baetis rhodani se jevila tolerantní ke kyselosti, avšak pouze když voda měla vysokou koncentraci iontů (zejména vápníku). Pokud by tedy potok byl chemicky vhodný, mohla by se B. rhodani vyskytovat, protože vhodná potrava - řasa Hormidium subtile byla přítomná. Pokud se v acidifikovaných vodách vyskytují pošvatky, pak tyto druhy pošvatek tolerantní ke kyselosti jsou všechny kouskovači (shredders), Mackay & Kersey (1985). Růst abundance shredders s klesajícím pH je často evidentní (Townsend et al . 1983, Townsend & Hildrew 1984) a v kyselých vodách jsou často dominantní skupinou (Simpson et al. 1985). Rovněž Hall et. al. (1980) pozorovali, že shredders byly více tolerantní k nízkému pH než jiné funkční skupiny. Po experimentálním okyselení lesního potoka drift shredders signifikantně nevzrůstal, zatímco drift kolektorů, škrábačů a predátorů vzrostl až 17x. Mackay a Kersey (1985) se domnívají, že schopnost většiny shredders tolerovat nízké pH může být vyvinuta jako adaptace umožňující jim vyrovnat se s lokálními kyselými podmínkami v ploškách rozkládající se organické hmoty; tj. adaptaci, která jim umožňuje kolonizovat kyselé habitaty v širokém měřítku. Listí napadané do toku na podzim se rozkládá v kyselých vodách pomaleji ve srovnání s neokyselenými a tak je k dispozici pro shredders po delší dobu než v tocích neokyselených. Experimentálně se pokusili studovat vliv acidifikace na tekoucí vody studovat Hall et al. (1980). Autoři okyselili tok na pH 4. Došlo ke zvýšení koncentrací některých kovů (Al, Ca, Mg, K), beze změny byly DOC, Na, NO3, NH3, Ni, Pb, Cu. Výlet imag jepic, některých pošvatek a Diptera se při nižším pH snížil.Větší množství nedospělých jedinců vodních bezobratlých, patřících do funkčních skupin škrábačů, kolektorů a predátorů, se v driftu zvýšil. Acidifikace toku snížila druhovou diverzitu, denzita bentosu poklesla. Biomasa perifytonu při nízkém pH vzrostla, ale denzita hub poklesla. Siveni nevykazovali žádné morfologické známky stresu při nízkém pH. Význam naakumulované organické hmoty v acidifikovaných jezerech a tocích v důsledku sníženého rozkladu zdůrazňují i Frankenhuyzen et al. (1985), jejichž výsledky ukázaly, že nízké pH neredukuje růst chrostíka Clistoronia magnifica (typický shredder) a dále že nízké pH ani nezvýšilo metabolické náklady posledních larválních instarů (4. a 5.). Rychlejší růst na listech je způsoben zlepšenou nutriční kvalitou nebo chutností listí. Tento vzrůst nutriční kvality je způsoben mikroorganismy. Kolonizace a „zpracováníí“ listí při pH 4 vyústilo ve dvojnásobnou bioamasu hub ve srovnání s listím kondiciovaném při pH 6 - to zvýšilo dostupnost energie z listí a mikroorganismů pro růst posledních instarů. Nízké pH redukovalo přežívání larev bezprostředně po vylíhnutí a během svlékání ze třetího do čtvrtého instaru. Avšak celkově zvýšený růst posledních larválních instarů nekompenzoval snížené přežívání prvních instarů, proto celková produkce shredders byla při kyselých podmínkách nižší (Frankenhuyzen et al. 1985). Frankenhuyzen & Geen (1986) dále zjistili, že listí olše kondiciované při pH 4 mělo vyšší fungální biomasu a bakteriální abundanci než listí kondiciované při pH 6. Zvýšený růst Clistoronia magnifica lze připočíst zvýšené fungální biomase na kondiciovaných listech při nízkém pH a zvýšené dostupnosti listové energie, pravděpodobně skrz modifikace listových substrátů houbovými enzymy. Ryby a vyšší obratlovciAcidifikované toky jsou často bez ryb.Acidifikace může ovlivňovat negativně fyziologii ryb v různém stupni života: oogenezi, spermatogenezi, embryonální vývoj. Byla pozorována vysoká mortalita larev v kyselých vodách, stejně jako inhibice růstu a dále patologické změny na játrech, Kossakowski (1989). Přehled krátkodobých vlivů acidity na ryby
Vyšší obratlovci Okyselování povrchových vod má důsledky pro distribuci a abundanci obojživelníků. Larvy obojživelníků jsou všeobecně více tolerantní k takovým podmínkám než embrya a tolerance vzrůstá s postupujícícm vývojem. Dospělí obojživelníci mohou být nalézáni ve vodě, kde premetamorfní stadia jsou usmrcována a jsou pravděpodobně více rezistentní než larvy a embrya. Nízké pH může způsobovat mortalitu embryí, zpoždění líhnutí nebo deformace vylíhlých larev. Terénní studie mnoha druhů obojživelníků prokázala, že jejich abundance a distribuce může být v relaci ke kvalitě vody. Mezi evropskými čolky rod Triturus, čolek hranatý (T. helveticus) se vyskytuje častěji v měkčí vodě rybníků než čolek obecný (T. vulgaris) a distribuce obou druhů vykazuje vztah ke geologii. Ačkoliv tyto dva druhy mohou koexistovat spolu, T. vulgaris je vzácně nacházen v rybnících o pH nižším než 6,0, zatímco T. helveticus toleruje pH vody až 4,0. mortalita embryí T. vulgaris vzrůstala rapidně pod pH 4,4. Při pH 4,0 žádné embryo nepřežilo líhnutí. Ačkoliv měkké vody jsou všeobecně více kyselé než tvrdé vody, distribuce obou čolků nejsou striktně v relaci ke kyselosti vody, stejně tak další parametry, jako jsou koncentrace kovových iontů, alkalinita a trofie, mohou být všechny korelovány s pH. není proto jasné, zda se oba dva druhy liší v odezvě na okyselování. Embrya čolků se při nízkém pH líhla v dřívějším stádiu vývoje, při nižší velikosti a dříve, než embrya v neutrálním prostředí. T. vulgaris se líhl v menší velikosti než T. helveticus, ale druh nebyl pH podstatně ovlivněn. Larvy obou druhů dorůstaly v kyselejších podmínkách menších rozměrů ve srovnání s larvami v neutrálním, Griffiths et al. (1993) Rovněž jiní obratlovci vázaní na vodu chybí nebo se vyskytují vzácně podél acidifikovaných úseků. Tato skutečnost byla nejlépe ukázána na skorci (Cinclus cinclus) a vydře (Lutra lutra). Indikace acidifikaceAcidifikace sladkých vod ovlivňuje všechny trofické hladiny v ekosystému jezer a řek. Ztráta rybích populací je nejčastěji pozorovaným jevem. Avšak ve většině případů se jedná o poslední biologickou změnu způsobenou okyselením. Vodní bezobratlí mohou být použiti jako "early warning organisms" pro indikaci rozdílných úrovní acidifikace (Raddum a Fjellheim 1984). Indikátorové organismy musí být euryekní, mít širokou distribuci a vyskytovat se ve velkém počtu. Musí být rovněž jednoduše identifikovatelní. Raddum et al. (1988) publikovali jednoduchý model pro výpočet stupně acidifikace řek a jezer založený na přítomnosti/nepřítomnosti senzitivních vodních organismů, konkrétně bentosu. Každá lokalita dostává skóre (rozpětí 0-1) v závislosti na přítomnosti/nepřítomnosti organismů indikujících rozdílný stupeň acidifikace. Pro výpočet čísla acidifikace je použit hierarchický systém. Indikátorové druhy o stejné toleranci k aciditě mají stejné číslo acidifikace. Autoři rozlišují 4 hladiny (stupně) tolerance: Kategorie A) druhy tolerující pH 5,5 ......číslo 1 Kategorie B) druhy tolerující pH 5,0 ......číslo 0.5 Kategorie C) druhy tolerující pH 4,7 ......číslo 0.25 Kategorie D) druhy tolerující pH 4,7 ......číslo 0 Acidifikační číslo je vypočteno následovně: Jestliže vzorek obsahuje jeden nebo více druhů kategorie A, lokalita dostane skore 1 (méně acidifikovaná). Jestliže druhy kategorie A chybí a jsou přítomné druhy kategorie B, indikují episodické okyselení na pH 5,0. V tomto případě je lokalita považována za středně acidifikovanou a dostává skore 0,5. Pokud kyselé episody neklesnou pod pH 4,7, mohou se vyskytovat menší mlži a lokalita dostává skore 0,5 Pokud jsou přítomné pouze druhy kategorie D, lokalita je považována za značně acidifikovanou a dostává skore 0. Do hodnocení je nutné zařadit pouze lokality, u nichž je předpoklad, že jsou ovlivněny pouze acidifikací a ne jiným faktorem. Systém je vhodný pro srovnání stupně acidifikace v rozdílných regionech a pro srovnání trendů acidifikace v čase. Seznam organismů citlivých k acidifikaci používaných při monitorování acidifikovaných povodí v Norsku (podle Raddum et al. 1988)
Příklady acidifikacíVysoké Tatry ex Stuchlík et al (1985) Autoři počátkem 80.tých let zjistili, že acidifikace se projevila i na území Vysokých Tater. Z výsledků sledování vlivu kyselých srážek do roku 1983 vyplynulo, že zde došlo k několikanásobnému zvýšení koncentrace SO42- a NO3- , doprovázenému výrazným poklesem alkalinity a poklesem pH. Výsledky byly získány v roce 1984 ze 111 jezer a menších stojatých vod nad hranicí lesa. Ze 132 jezer a menších stojatých vod sledovaných v letech 1980-83 mělo jen 14 % lokalit alkalinitu vyšší než 100 mikroekvi/l (tj. vody acidifikací dosud bezprostředně neohrožené), 44 % alkalinitu 20-100 meq.l-1 (vody acidifikací ohrožené) a 420 alkalinitu nižší než 20 meq.l-1 (vody acidifikované). Průměrné hodnoty pH pro uvedené tři skupiny byly 6,9, 6,3 a 5,3. pH se s klesající alkalinitou mění zpočátku jen nepatrně, k výraznému poklesu pH dochází až při hodnotách alkalinity pod 20 meq.l-1. Hodnoty současné alkalinity však poskytují jen omezenou informaci o stupni acidfikace jezer, respektive o citlivosti jezer k acidifikaci. Nízká hodnota alkalinity totiž může být důsledkem celkově nízké koncentrace iontů nebo velkého přísunu kyseliny ve srážkách, případně obou faktorů. Rovněž odolnost jezera vůči acidifkaci nemusí odpovídat současné alkalinitě - může být vyšší v důsledku zvyšování koncentrace Ca v průběhu acidifikace. Aktuální stav acidfikace jezer ve Vysokých Tatrách lze shrnout těchto bodů:
Chemické charakteristiky 53 jezer (srpen 1984). Průměrné hodnoty (meq.l-1) jsou vypočteny pro 3 kategorie jezer se stejným rozpětím alkalinity (ex S+ S- )
ex Stuchlíková et al. (1985) Jezera s alkalitou menší než 20 meq.l-1 mají až o řád nižší koncentrace chlorofylu-a a zooplankton, žijící zde ještě před rokem 1973, dnes chybí. Vztah mezi acidifikací a přímými počty bakterií nebyl nalezen. Acidifikace je součaně provázena snížením počtu druhů řas, ve fytoplanktonu acidifikovaných jezer převládají Dinoflagellata. Počet druhů zooplanktonu rovněž se zvyšující kyselostí vody klesá. Situace pozorovaná u tatranských a šumavských jezer, kdy zooplankton v důsledku poklesu pH vymizel zcela, je však ojedinělá. Fott et al. 1994 Na základě recentních změn zooplanktonu mohou být tatranská jezera rozdělena do tří skupin: a) druhové složení planktonních korýšů zůstalo nezměněno b) planktonní korýši jsou od roku 1973 nepřítomní c) z původních druhů je přítomen pouze druh Chydorus sphahericus Tyto tři skupiny jsou dobře odlišitelné podle jejich koncentrace Ca, ANC a pH. Jako základní byl vzat limit ANC 0-25 meq.l-1. Všechna jezera s ANC negativním a pH nižší než 5 byla invadována Chydorus sphaericus.Jezera s ANC 0,25 meq.l-1 a pH 5-6 ztratila zooplankton. Většina jezer s ANC nad 25 meq.l-1 a ph vyšším než 6 měla zooplankton nezměněn. Recentní absenci zooplanktonu lze vysvětlit hladověním, které následuje po ultraoligotrofii. Jestliže jezero je acidifikována na hodnotu pH 5-6, ztrácí fosfor vlivem srážení fosfátů s hliníkem. Tato jezera pak mají i nejnižší koncentrace chlorofylu. Šumavaex Fott et al. (1994) Od roku 1979 nebyl nalezen žádný planktonní korýš v Čertově a Černém jezeru na Šumavě. Hodnota pH klesla z hodnot 5,7-6,9, resp. 6,9-7,0 v roce 1936 na 4,3-4,8 v obou jezerech. Koncentrace labilního monomerního hliníku byly 0,83 a 0,68 a tyto vysoké hladiny toxického hliníku mohly být zodpovědné za vymizení planktonních korýšů z obou jezer. Nelabilní monomerický Al tvořil zhruba 1 % celkového reaktivního Al v Jezerech Černé a Čertovo. Jezera jsou rovněž bez ryb. Fytoplankton jezer je velmi chudý a podobný, dominantní skupinou jsou flageláta. Druhové složení je podobné jiným acidifikovaným jezerům. Srovnání současného stavu se starými nálezy značí, že fytoplanktonní druhy vyskytující se v oligotrofních jezerech senzitivních k acidifikaci jsou schopné přežívat, pokud jsou tato jezera acidifikována.
Obr. Vliv acidifikace na biotu šumavských jezer ex Henriksen et al. (1997) V acidifikovaných územích v jižním Norsku poklesly od roku 1980 depozice sulfátů o 40 %, zatímco koncentrace dusičnanů zůstaly během této doby stejné. Vlhká depozice dusíku je dnes cca 2x vyšší než u síry. Koncentrace P v jezerech a řekách v povodí řeky Bjekreim jsou extrémně nízké a jsou často pod hranicí stanovitelnosti. Kombinovaný efekt vysokého přísunu N, vysokých srážek a nízkého obsahu P v půdě a povrchové vodě podporuje myšlenku, že vysoké koncentrace NO3- v odtoku by mohl odrážet limitaci P v půdě. Management vodních ploch – náprava acidifikace
Časově omezenou úlevu vodních ploch od
acidifikace můžeme dosáhnout vápněním – dodáním jemně mletého vápence
(CaCO3) buď na hladinu jezera, do říčního přítoku, do mokřadu umístěného
proti proudu nebo do povodí. Čím jemnější jsou částečky vápence, tím
rychleji se rozpouští a ztráty sedimentací ve vodě jsou menší. Na zvýšení pH
z 4,5 na 6,5 je potřeba zhruba 5mg/l jemného a nejlépe rozpustného a 10mg/l
hrubšího a méně rozpustného vápence. Pokud je vápenec aplikován přímo na
hladinu vody jezera nebo mokřadu, nejdříve neutralizuje kyseliny a umožní
precipitaci hliníku; jeho přebytek slouží jako buffer proti dalšímu vstupu
kyselin z atmosféry nebo z přítoku. Literatura: BARLOCHER, F., PETERSEN, R.C. (1988): Aquatic hyphomycetes in an acidified and limed humic stream in Sweden. Verh. Internat.Verein. Limnol. 23: 1279 - 1286 BONACINA, C., BONOMI, G., GAZZERA, S., SALMOIRAGHI, G. (1991): Breakdown rates of alder (Alnus glutinosa) leaves in an acid lake (Lake Orta, North Italy). Verh. Internat. Verein. Limnol. 24: 1041 - 1043 CARPENTER, J., ODUM, W.E., MILLS, A. (1983): Leaf litter decomposition in a reservoir affected by acid mine drainage. Oikos 41: 165 - 172 CLYMO, R.S. , HAYWARD, P.M. (1982): The ecology of Sphagnum. Pp. 229 - 289. In: Smith, A.J.E. (ed.): Bryophyte ecology. Chapman & Hall, London FOTT,J.(ed.)(1994): Limnology of Mountain Lakes. Kluwer Academic Publishers, Dordrecht - Hydrobiologia 274 (1994) FOTT,J.,PRAŽÁKOVÁ,M.,STUCHLÍK,E.,STUCHLÍKOVÁ,Z.(1994): Acidification of lakes in Šumava (Bohemia) and in the High Tatra Mountains (Slovakia). Hydrobiologia 274: 37 - 47 FOTT,J.,STUCHLÍK,E.,STUCHLÍKOVÁ,Z.,STRAŠKRABOVÁ,V.,KOPÁČEK,J.,ŠIMEK,K.(1992): Acidification of lakes in Tatra Mountains (Czechoslovakia) and its ecological consequences. . In: Mosello,R.,Wathne,B.M.,Giussani,G.(eds.): Limnology on group of remote lakes: ongoing and planned activities. Documenta Ist.ital.Idrobiol. 32: 69 - 81 GRAHN, O., HULTBERG, H., LANDNER, L. (1974): Oligotrophication - a self-accelerating process in lakes subjected to excessive supply of acid substances. Ambio 3: 93 - 94 HALL, R.J., LIKENS, G.E., FIANCE, S.B., HENDREY, G.R. (1980): Experimental acidification of a stream in the Hubbard Brook Experimental Forest, New Hampshire. Ecology 61: 976 - 707 HARRIMAN, R., MORRISON, B.R.S. (1982): Ecology of streams draining forested and non-forested catchments in an area of central Scotland subject to acid precipitation. Hydrobiologia 88: 251 - 255 HARRISON, A.D. (1958): The effects of sulphuric acid pollution on the biology of streams in the Transvaal, South Africa. Verh. Internat. Verein. Limnol. 13: 603 - 610 HILDREW, A.G.,ORMEROD, S.J. (1995): Acidification: Causes, consequences and solutions. pp. 147 - 160. In: Harper, D.M., Ferguson,A.J.D.(eds.): The ecological basis for river management. John Wiley & Sons Ltd KIMMEL, W.G., MURPHEY, D.J., SHARPE, W.E., DeWALLE, D.R. (1985): Macroinvertebrate community structure and detritus processing rates in two southwestern Pennsylvania streams acidified by atmospheric deposition. Hydrobiologia 124: 97 - 102 KOPÁČEK,J.,STUCHLÍK,E.(1994): Chemical characteristics of lakes in the High Tatra Mountains, Slovakia. Hydrobiologia 274: 49 – 56 KOSSAKOWSKI, K.M. (1989): Wplyw zakwasenia wód na ryby. Wiadomošci Ekologiczne, 35,1: 61-72 LUKAVSKÝ,J.(1994): Algal flora of lakes in the High Tatra Mountains (Slovakia). Hydrobiologia 274: 65 - 74 MACKAY, R.J., KERSEY, K.E. (1985): A preliminary study of aquatic insect communities and leaf decomposition in acid streams near Dorset, Ontario. Hydrobiologia 122: 3 -11 MARCHETTO,A.,BARBIERI,A.,MOSELLO,R.,TARTARI,G.(1994): Acidification and weathering processes in high mountain lakes in Southern Alps. Hydrobiologia 274: 75 - 81 MOSELLO,R.,BARBIERI,A.,MARCHETTO,A.,PSENNER,R.,TAIT,D.(1992): Research on quantification of the susceptibility of alpine lakes to acidification. In: Mosello,R.,Wathne,B.M.,Giussani,G.(eds.): Limnology on group of remote lakes: ongoing and planned activities. Documenta Ist.ital.Idrobiol. 32: 23 - 30 NILSSEN, J.P. (1980): Acidification of a small watershed in southern Norway and some characteristics of acidic aquatic environments. Int. Revue ges. Hydrobiol. 65, 2: 177 - 207 OTTO, C., SVENSSON, B.S. (1983): Properties of acid brown water streams in souith Sweden. Arch.Hydrobiol. 99: 15 - 36 PRAŹÁKOVÁ, M. (1994): Zbytky Cladocer v sedimentu Černého jezera. pp. 160 -164. In: Zborník referátov X. limnologickej konferencie , Stará Turá RADDUM, G.G., FJELLHEIM, A., HESTHAGEN, T. (1988): Monitoring of acidification by the use of aquatic organisms. Verh. Internat. Verein. Limnol. 23: 2291 - 2297 SCHMIDT,R.,PSENNER,R.(1992): Climate changes and anthropogenic impacts as causes for pH fluctuations in remote high alpine lakes. In:Mosello,R.,Wathne,B.M.,Giussani,G.(eds.): Limnology on group of remote lakes: ongoing and planned activities. Documenta Ist.ital.Idrobiol. 32: 31 - 57 SMITH,M.E.,WYSKOWSKI,B.J.,BROOKS,C.M.,DRISCOLL,C.T.,COSENTINI,C.C.(1990): Relations between acidity and benthic invertebrates of low-order woodland streams inthe Adirondack Mountains, New York. Can.J.Fish.Aquat.Sci. 47: 1318 - 1329 SOLDÁN, Z. (1998): Tajemství mechorostů: 5. „Obyčejný rašeliník“. Živa 46,6: 252 - 254 STUCHLÍK,E.,STUCHLÍKOVÁ,Z.,FOTT,J.,VRBA,J.,ČERNÝ,M.(1985): Nové poznatky o acidifikaci jezer ve Vysokých Tatrách. In: Sborník přednášek ze VII. konference ČSLS, Nitra, pp. 225 - 228 STUCHLÍKOVÁ,Z.,STUCHLÍk,E.,FOTT,J.(1985): Acidifikace a plankton jezer ve Vysokých Tatrách. In: Sborník přednášek ze VII. konference ČSLS, Nitra, pp. 229 - 232 SUTCLIFFE, D.W., CARRICK, T.R. (1973): Studies on mountain streams in the English Lake District. 1. PH, calcium and the distribution of invertebrates in the River Duddon. Freshw. Biol. 3: 437 - 462 TOWNSEND, C.R., HILDREW, A.G. (1984): Longitudinal pattern in detritivore communities of acid streams: a consideration of alternative hyporheses. Verh. Internat. Verein. Limnol. 22: 1953 - 1958 TOWNSEND, C.R., HILDREW, A.G., FRANCIS, J. (1983): Community structure in some southern English streams: the influence of physicochemical factors. Freshw. Biol. 13: 521 - 544 VIAROLI,P.,FERRARI,I.,MANGIA,A.,ROSSI,V.,MENOZZI,P.(1992): Sensitivity to acidification of Northern Apennines lakes (Italy) in relation to watershed characteristics and wet deposition. In: Mosello,R.,Wathne,B.M.,Giussani,G.(eds.): Limnology on group of remote lakes: ongoing and planned activities. Documenta Ist.ital.Idrobiol. 32: 93 - 105 VESELÝ,J.,MAJER,V.(1992): The major importance of nitrate increase for the acidification of two lakes in Bohemia. In: Mosello,R.,Wathne,B.M.,Giussani,G.(eds.): Limnology on group of remote lakes: ongoing and planned activities. Documenta Ist.ital.Idrobiol. 32: 83 - 92 VRANOVSKÝ,M.,KRNO,I.,ŠPORKA,F.,TOMAJKA,J.(1994): The effect of anthropogenetic acidification on the hydrofauna of the lakes of theWest Tatra Mountains (Slovakia). Hydrobiologia 274: 163 - 170 VYHNÁLEK,V.,FOTT,J.,KOPÁČEK,J.(1994): Chlorophyll-phosphorus relationship in acidified lakes of the High Tatra Mountains (Slovakia). Hydrobiologia 274: 171 - 177 WATHNE,B.M.(1992): Acidification of mountain lakes: paleolimnology and ecology. The AL:PE Project. In: Mosello,R.,Wathne,B.M.,Giussani,G.(eds.): Limnology on group of remote lakes: ongoing and planned activities. Documenta Ist.ital.Idrobiol. 32: 7 - 22 WILLOUGHBY, L.G. (1988): The ecology of Baetis muticus and Baetis rhodani (Insecta, Ephemeroptera), with special emphasis on acid water backgrounds. Int. Revue. ges. Hydrobiol. 73, 3: 259 - 273 WOJTAN,K.,GALAS,J.(1994): Acidification of small mountain lakes in the High Tatra Mountains, Poland. Hydrobiologia 274: 179 - 182 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||