|
Fosfor
Fosfor je prvek, který se ve
vodách vyskytuje v organických nebo anorganických sloučeninách. Anorganické
formy jsou ortofosforečnany a polyfosforečnany, přičemž nejčastější formou
výskytu jsou ortofosforečnany. Fosforečnanové ionty se lehko váží na železo,
hliník a vápník, se kterými vytváří jednoduché soli nebo komplexy, jejichž
rozpustnost se mění v závislosti na pH a nasycení vody kyslíkem.
Polyfosforečnany mohou mít strukturu buď řetězovou (katenapolyfosforečnany),
či cyklickou (cyklopolyfosforečnany). Autotrofy je fosfor přijímán a
využíván ve formě rozpustných fosforečnanů. Nerozpuštěný anorganický fosfor
je tvořen fosforečnany vápníku, hořčíku, železa a hliníku, a to buď volně
dispergovanými nebo chemicky či sorpčně vázanými na anorganických nebo
organických nerozpuštěných látkách nebo sedimentech.
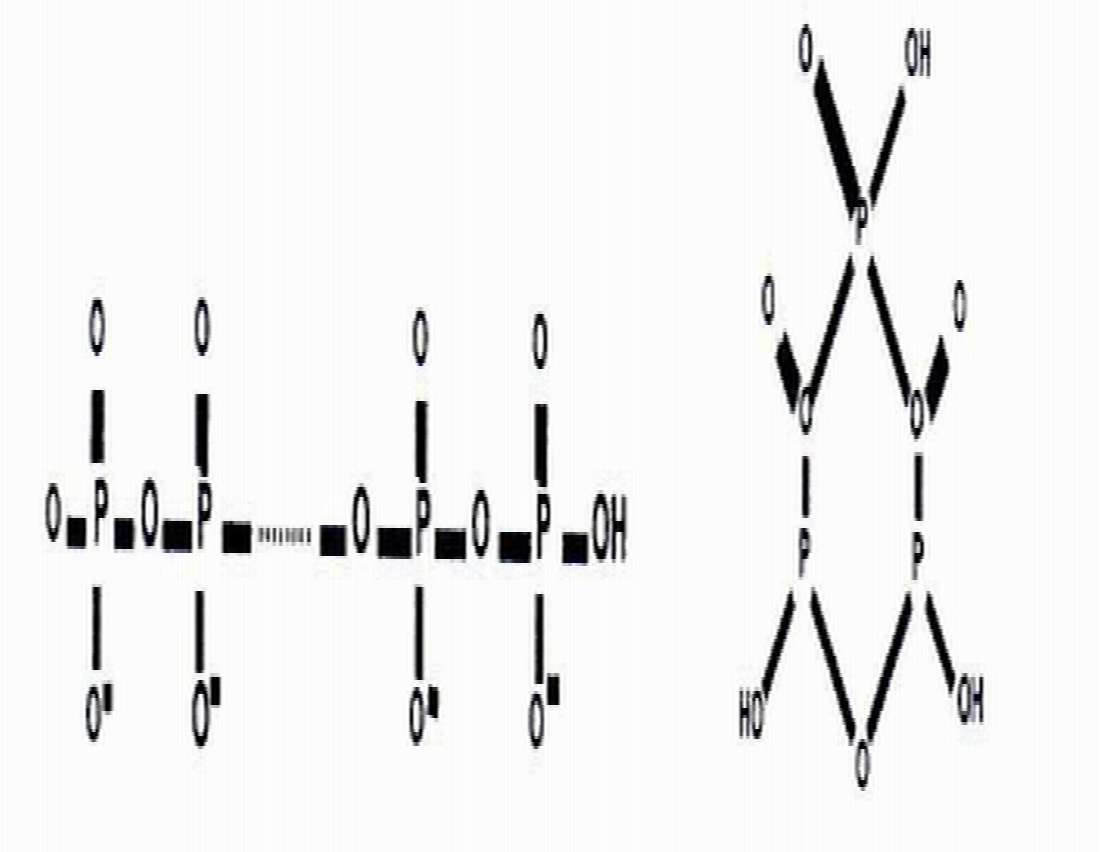
Obr. Struktura řetězová (katenapolyfosforečnany)
nebo cyklická (kyselina cyklotripolyfosforečná)
Zdroj: Tolgyessy, 1993
Mezi formy organicky vázaného
rozpuštěného fosforu patří např. fosfáty hexos, fosfolipidy, fosfoproteiny,
koenzymy ADP a ATP, nukleové kyseliny nebo organofosforové pesticidy.
Nerozpuštěný organický fosfor je obsažen v organismech a jejich zbytcích ve
volné vodě a v sedimentech. Extracelulární enzymy baktérií a řas dokáží
hydrolyzovat tento organicky vázaný fosfor do formy fosforečnanů. Nejlépe
biologicky využitelnou formou fosforu jsou ionty H2PO4-. Jejich koncentrace
ve vodě je však obyčejně nízká, protože jsou velmi nestálé. V neutrálním
prostředí reagují s hydrogenuhličitany a mění se na méně využitelnou formu
(HPO42-) (Hejzlar et al. 1994).
2 H2PO4- + HCO3- = 2 HPO42- + 2H2O + CO2
Pokud nejsou v této formě organismy využity, reagují dále za vzniku
nerozpustného fosforečnanu:
2 HPO42- + 2 HCO3- = 2 PO43- + 2H2O + CO2
Reakcí s hydrohenuhličitany se
účastní i vápník, ale pouze v případě, že pH je vyšší než 10,5.
Ve vodě s intenzívní mikrobiální činností je často několikanásobně víc
fosforu ve sloučeninách, uvolněných hydrolýzou, než v rozpuštěných
fosforečnanových iontech anorganického původu.
Obr. Diagram ukazuje relativní důležitost dostupného fosforu (A) na
molekulární úrovni a (B) podle jeho zdrojů
Zdroj: Vollenweider, 1979
Ve srovnání s jinými biogenními
prvky má fosfor mimořádný význam jako prvek často limitující produkční
procesy ve vodních ekosystémech. Je to dáno rozdílem mezi jeho poměrným
zastoupením v živých organismech a jeho zdroji v prostředí. V organismech je
podíl fosforu vyšší a stálý, v prostředí nižší a proměnlivý, což způsobuje
jeho sedimentární cyklus a proměnná intenzita využití rostlinami (Lellák,
Kubíček, 1991). Některé povrchové vody, například slepá ramena řek, jsou v
jarním období limitována fosforem, ale v letních měsících se limitujícím
faktorem může stát dusík nebo křemík.
Hmotnostní poměr sloučenin C:N:P v rostlinné biomase je 40C:7N:1P, a v
atomárním poměru 106C:16N:1P (Redfield ratio). V přirozených povrchových
vodách je tento poměr 600C:20N:1P. V eutrofních vodách stechiometrický poměr
N:P určuje, který nutrient je pravděpodobně limitující pro růst řas. Poměr
N:P > 16:1, respektive > 30:1, je limitujícím prvkem fosfor, při N:P < 16:1,
resp. < 10:1, limituje růst fytoplanktonu dusík. Jako indikátor stupně
limitace fytoplanktonu fosforem lze použít i poměr C:P. Poměr C:P v rozmezí
130-260 indikuje mírnou limitaci, C:P 260 velmi silnou limitaci (Hejzlar
et al. 1994).
Fosfor v sedimentu
Hodnota redox potenciálu ~200mV v hraniční vrstvě vody těsně nad dnem s
rostoucí eutrofizací nebo organickým znečištěním umožňuje dekompozici
většímu množství sedimentovaných organických látek. Když na povrchu
zavládnou anoxické podmínky (letní, zimní stagnace), komplexy FeOOHPO4 (Fe
3+) se rozpouštějí a PO43- ( i Fe2+) může unikat do hypolimnionu.
Intersticiální koncentrace PO43- je obvykle 5-20x větší než v hraniční
vrstvě vody, což umožňuje rychlou difuzi.
Model železo-fosforečnan je komplexnější, než se původně zdálo. Nejen
železo, ale i sírany mohou ovlivnit uvolňování fosforečnanů z anoxických
sedimentů. Mikrobiálními redukčními procesy z SO42- vznikají sirníky S2-,
které mohou tím, že vytváří vysoce nerozpustné FeS nebo FeS2, odčerpat z
roztoku tolik redukovaného železa, že umožní adsorbovanému fosforu uniknout.
Nové výzkumy v mělkých dánských jezerech ukazují, že uvolňování fosforu ze
sedimentů v přítomnosti kyslíku je zanedbatelné, je-li hmotnostní poměr Fe:P
v povrchových sedimentech větší než 15-20, a naopak velké, je-li poměr menší
než 10 – zřejmě proto, že zde pak není dostatek železa, které by vázalo a
vysráželo rozpuštěný fosfor, unikající vzhůru do vody (Jensen et al. 1992).
Jiné výzkumy ukázaly, že když se sediment dostává opět do suspenze, zvyšuje
se v mělkých eutrofických jezerech uvolňování fosforu (Hamilton and Mitchell
1988).
Nejnovější studie ukazují, že rychlost uvolňování fosforu je velmi ovlivněna
procesy dekompozice, zahrnujícími činnost mikroorganismů, a tudíž spíše
biologickými, než chemickými mechanismy. Baktérie se přímo účastní
uvolňování rozpustného reaktivního fosforu (SRP) do vody, které následuje po
rozpadu jejich buněk; v anaerobních podmínkách probíhá uvolňování
mikrogranulí polyfoforečnanů, které byly dříve za aerobních podmínek
akumulovány. Ať jsou přesné mechanismy jakékoli, biologické uvolňování je
důležité – odhadem 10-75% fosforu není adsorbováno, ale vázáno v buňkách
mikroorganismů (Boström et al. 1988).
Klasická teorie se zdá být nepoužitelná v případě mnoha jezer v Quebecu, v
jejichž anoxickém hypolimniu nebyl nalezen žádný vztah mezi železem a
uvolňováním fosforu, a také v případě mnohých oligotrofních jezer, které se
mohou stát anoxickými, aniž by k uvolňování fosforu docházelo (Prairie et al.
2001). Zdá se, že toto uvolňování nezávisí ani tak na hypolimnetických
koncentracích rozpuštěného kyslíku, jako spíš na rovnováze mezi zásobou
fosforu v sedimentujících částicích a – stále špatně prozkoumanou - retenční
kapacitou, závislou na biologických a chemických procesech. V praxi ve
skutečnosti nezáleží na tom, je-li fosfor součástí komplexu se železem nebo
mikroorganismů. Pochopení, jak organismy fosfor zadržují, je však klíčové
pro porozumění zásadním skrytým mechanismům, které jsou zajímavé nejen samy
o sobě, ale mohou také vést k vytvoření lepších prediktivních modelů.
|
Environmentální parametry |
Vliv na uvolňování fosforu |
|
Redox potenciál |
Hodnoty redox potenciálu pod 200 mV indukují
redukci nerozpustného Fe(III) na rozpustné Fe(II) |
|
pH |
Zvýšení pH sníží fosfor vázací kapacitu Fe a Al
sloučenin, primárně z důvodu reakce s výměnou ligandů, kde hydroxidový
iont nahradí fosforečnan. Tvorba vápence a apatitu při vyšších
hodnotách pH zvyšuje fosfor vázací kapacitu vápníku |
|
Teplota |
Zvýšení teploty má hlavně nepřímé vlivy: zvýší se
bakteriální aktivita, která zvýší spotřebu kyslíku a sníží redox
potenciál a pH. Produkce fosforečnan mobilizujících enzymů a agens,
tvořících cheláty, se také může úměrně zvýšit |
|
Kritéria rovnováhy |
Ovlivňují procesy adsorpce-desorpce a disociaci
precipitátu |
|
Agens tvořící cheláty |
Nahrazují fosforečnan v solích vápníku, železa a
hliníku. Mohou být produkovány bakteriemi a řasami, nebo se objevují
jako znečišťující látky |
Tab. Vliv důležitých
environmentálních faktorů na mobilizaci fosforu
Zdroj: Boström et al 1982
Použití Fosforu
Sloučeniny fosforu se ve velkém množství používají jako průmyslová hnojiva
(např. superfosfát) a jedná se o jejich nejvýznamnější použití. Jako další
použití fosforu a jeho sloučenin lze jmenovat:
• výroba pracích prostředků a dalších detergentů
• výroba speciálních skel pro sodíkové lampy
• fosforečnan vápenatý- výroba porcelánu, složka prášku do pečiva
• využití v hutnictví (výroba fosforové bronze a další)
• využití jako změkčovadla vody a inhibitory koroze
• vojenské využití (zápalné či kouřové pumy)
• výroba zápalek, signálních raket a pyrotechniky
• v menší míře výroba polovodičů, pesticidů či zubních past
Zdroje znečištění
Přírodním zdrojem fosforu ve
vodách je rozpouštění a vyluhování některých minerálů a zvětralých hornin
(apatit).
Antropogenním zdrojem anorganického fosforu je především aplikace
fosforečnanových hnojiv a odpadní vody z prádelen a dalších provozů, do
kterých se dostávají fosforečnany z pracích prostředků. V průměru tvoří 70%
z celkového množství.. Dalším zdrojem jsou polyfosforečnany používané v
čistících a odmašťovacích prostředcích a jako protikorozní a
protiinkrustační přísady. Fosfor se dostává do vody i splavováním při
hnojení luk a pastvin - to činí v průměru 10% z celkového množství.
Zdrojem organického fosforu je fosfor obsažený v živočišných odpadech.
Specifická produkce fosforu se pohybuje mezi 2 – 3 g fosforu na obyvatele a
den. Organicky vázaný fosfor je produktem biologických procesů (rozklad
vodní flóry a fauny, živočišné odpady, procesy biologického čištění
odpadních vod apod.). Sloučeniny tohoto typu se vyskytují v městských
splaškových vodách, odpadních vodách z potravinářského průmyslu apod.
Bodové zdroje
• Vtok odpadní vody (komunální
nebo průmyslové)
• Odtok a vyluhování ze skládek odpadů
• Odtok a prosakování z velkochovů zvířat
• Odtok z dolů, ropných nalezišť a průmyslových zón bez kanalizace
• Přetečení kombinovaných čističek odpadní a dešťové vody
• Odtok ze stavenišť o velikosti pod 20.000m2
Plošné zdroje
• Odtok ze zemědělství nebo
zavlažování
• Odtok z pastvin
• Odtok z městských oblastí bez kanalizace
• Únik ze septiku
• Odtok ze stavenišť o velikosti nad 20.000m2
• Odtok z opuštěných zdrojů
• Atmosférické depozice
Obr. Charakteristika bodových a
plošných zdrojů znečištění
Zdroj: Carpenter, 1998
Formy Fosforu
Ze spíše praktických než teoretických důvodů je za klíčovou proměnnou
eutrofizace považován celkový fosfor (TP – total phosphorus) a ne některá z
jeho forem. Celkový fosfor obsahuje některé nebo i všechny z následujících
frakcí: fosfor krystalický, vázaný, absorbovaný, organický partikulovaný,
organický rozpustný a anorganický rozpustný. Ze všech těchto druhů tvoří
následující tři skupinu biologicky dostupného fosforu (BAP - biologically
available phosphorus) – v pořadí od největší po nejmenší dostupnost:
rozpustný reaktivní fosfor (SRP – soluble reactive phosphorus) – směs
rozpuštěných organických i anorganických forem, měřených metodou podle
Murphyho a Rileye, rozpustný nereaktivní fosfor (SURP - soluble unreactive
phosphorus – zahrnuje fosfor vznikající oxidací peroxidisírany, dostupný pro
fytoplankton následkem enzymatického rozkladu, jenž uvolňuje organicky
vázané frakce), a labilní fosfor (spojovaný s částečkami půdy a rozpuštěný
ve vodním roztoku tak, jak se dá určit metodou sorpční isotermy - Tayler and
Kunishi).
Obr. Formy fosforu
|
